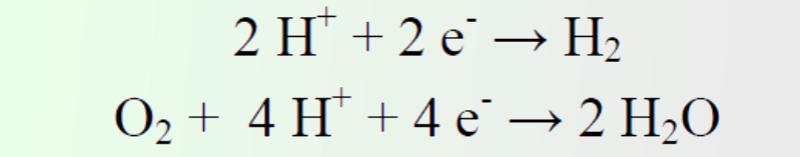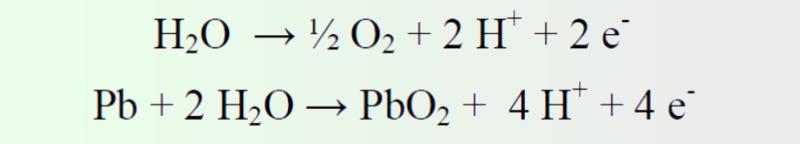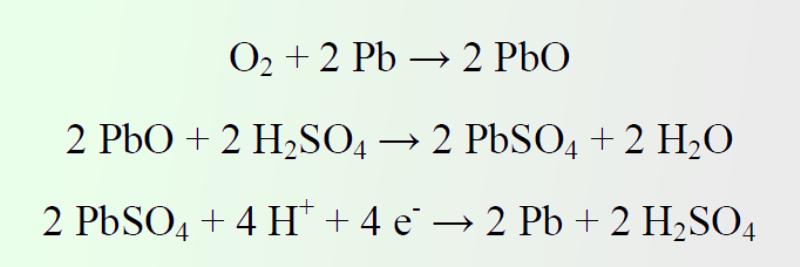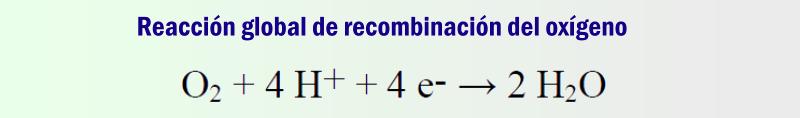TALLER |
|
|
Tras un largo período de pruebas tras el interés suscitado por la primera parte continuamos una serie de reportajes más específicos sobre reparación de baterías, donde hemos comprobado la poca eficacia de los métodos que se difunden por Internet donde os damos algunos consejos y explicaciones más realistas basándonos en las pruebas realizadas, la descripción de los procesos industriales de fabricación y las posibles técnicas para reutilizar una batería de una manera real.
Atención, muy importante:
Antes de nada, advertir que este reportaje se centrará únicamente en los acumuladores de plomo-ácido y no en otros tipos de baterías como las de Litio o Niquel-Cadmio. Para poder entender lo que ponemos en este reportaje, si no conoces el funcionamiento y terminología de una batería, te aconsejamos leas antes la primera parte o es probable que no comprendas muchas cosas que asumimos que ya sabes. Primero hemos comprobado si los mitos son falsos: ¡Afirmativo! Para poder analizar con detenimiento los efectos de un lavado “mecánico” como el descrito en los canales de Internet, tomamos 15 baterías de plomo de coche y camión de 12V y 24V y 6 vasos acumuladores para energía solar de 1,2 V. Pudimos constatar las suposiciones que ya teníamos sobre este tipo de lavados, es decir, apenas consiguen una mejora parcial de la batería por tiempo muy limitado. Para asegurarnos bien hemos sometido a un total de 24 baterías de 12V y 12 vasos acumuladores de 12V a diferentes pruebas reparaciones y largos seguimientos de degradación, cuyos resultados a largo plazo y las técnicas de mantenimiento iremos relatando también en sucesivos reportajes, así como otros métodos de carga solar, eólica o por turbina de agua. Queremos advertir que cuando hablamos de la vida de una batería, nos referimos a una duración medida en años, por lo que pese al tiempo transcurrido desde la primera publicación y el siguiente estudio puede que aún fuese necesario períodos más extensos, aunque la degradación sufrida en la mayoría de los casos, tras la aplicación de los métodos descritos en Internet y la menor pérdida de rendimiento a la hora de emplear un método más correcto y “separadores” adecuados, hace innecesario continuar la espera para explicar los resultados.
El ejemplo más recurrente si buscamos por Internet para reparar las baterías de plomo es aquel donde encontraremos al “genio” de turno, que nos explica como devolverla a la vida “lavándola” con una solución de bicarbonato u otra sustancia más difícil de encontrar, aclarando después con agua destilada y rellenando de nuevo con electrolito. Cuando el vídeo termina, el “experto” conecta la batería a un cargador y luego observa como el polímetro recoge un aumento de voltaje o enciende una bombilla.
Efectivamente, incluso puede ocurrir que suba el voltaje e incluso recupere puntualmente algo de carga! Pero eso no significa que haya reparado la batería, pero el procedimiento que se explica en todos estos vídeos parte de un planteamiento casi cierto para unos mínimos casos puntuales y que NUNCA se detalla con claridad, además el método que se explica para intentar reparar la batería en la práctica resulta completamente INCORRECTO, IMPRECISO, PELIGROSO Y TÓXICO. Para empezar, el resultado de “lavar” una batería solo suele ser efectivo cuando la batería está por encima de los 10,5 V y ninguno de los vasos esté cortocircuitado o mucho más deteriorado que el resto. En caso de un cortocircuito que dañe un vaso, aunque de alguna manera consigamos quitar el corto circuito, nada de lo que hagamos tiene un efecto real, el daño causado en ese vaso tiende a “descompensar” el proceso químico y rápidamente la capacidad de carga en el resto, acortando la vida de la batería por una carga incorrecta. Limpieza de sedimentos, corrosión y efectos en la tensión por vaso En las baterías de plomo-ácido inundadas, los tipos de fallo principales pese a un uso correcto se manifiestan por la sulfatación, los sedimentos debidos a excesivos ciclos, ocurren de manera natural, como el crecimiento de las rejillas positivas (oxidación), Así que es simplemente una cuestión de tiempo hasta que la batería falle y solo la calidad de los componentes y aditivos o la equalización reducirá esto durante un tiempo relativamente corto de tiempo. La limpieza de los sedimentos mejora un poco el rendimiento y la duración. Pero en definitiva, eso es casi todo lo que se puede hacer sobre la batería bajo unas condiciones correctas de uso, así que mediante una limpieza mecánica solo se mejora la calidad del electrolito y parcialmente las reacciones químicas en la superficie de las placas. Pensemos en los locos "experimentos" sugeridos en Internet: A medida la limpieza mecánica con bicarbonato u otras sales resulta más agresiva el resultado tiende a ser más aleatorio dependiendo su efecto sobre el plomo esponjoso y la proporción de dióxido de plomo / sulfato de plomo, o como escucharemos muchas veces: la "sulfatación". Este resultado aleatorio dependiendo del estado inicial puede devenir en algunos casos en una suma total de voltajes de los diferentes vasos que dé la impresión de una mejora real, pero es completamente falso. Esto se comprueba al medir la tensión vaso por vaso y la medición de la carga devuelta según se reduce la tensión, donde claramente se observa diferencias en el voltaje de cada vaso (dentro del rango completo 1,9 V @ 2,15V) y se puede comparar la curva resultante con la de una batería en buen estado. Igualmente sucede con la relación de “tensión/carga y tensión/retención de carga” mostrándose claramente una tensión de carga muy inferior a la correspondiente y un rápido aumento de la tensión que se agrava en ciclos sucesivos. El desequilibrio resultante en cada vaso no es apreciable en las primeras cargas, pero acelera la degradación rápidamente pasado un periodo inicial. Esto ocurre porque se produce una sobrecarga constante en los vasos con cada carga, ya que los cargadores son “engañados” por los vasos dañados de las baterías que dan una información incorrecta al cargador.
Una manera muy sencilla de poder comprobar si existen cortocircuitos en los vasos consiste en medir la tensión directamente en cada vaso empleando un polímetro haciendo contacto con los bornes (es aconsejable usar una extensión o contactos bien sellados para que el ácido sulfúrico no dañe el metal de los terminales de nuestro polímetro).
Si todo funciona correctamente podemos introducir directamente los terminales en los vasos y obtener una lectura secuencial y ascendente constante, así que del primer al segundo vaso y a continuación, deberíamos obtener las siguientes lecturas aproximadas, teniendo en cuenta que lo más importante es una lectura del múltiplo correspondiente: Primero a Segundo Vaso: 2.1V aprox Segundo a Tercer Vaso: 4.2V aprox Tercero a Cuarto Vaso: 6.3V aprox. Cuarto a Quinto Vaso: 8.4 V aprox Quinto a Sexto Vaso: 10.5 V aprox -¿Porqué 10.5V y no 12.6V? Parece lo lógico ¿No? Es incorrecto porque la secuencia “en serie” completa correspondería desde el primer polo negativo al último positivo y por tanto: 10.5V + 2.1= 12.6 V Estos serian por ejemplo los valores para una batería bastante descargada pero sin cortocircuitos. Debemos tener en cuenta que la lectura entre vasos suele ser un poco menor que la real. Una creencia común en los cortocircuitos es pensar que se producen solo entre vasos diferentes, pero se provocan igualmente en los mismos vasos y es probable que sean los más comunes (y cada vez más, a medida se usan placas y aislantes más finos o con tendencia a desintegrarse). Los sedimentos, los dobleces en las mayas y las láminas, la degradación de los aislantes, etc. producen estos cortocircuitos y se encuentran fácilmente al realizar estas lecturas. Cuando encontremos una anomalía en la secuencia solo tenemos que tomar los terminales y medir únicamente con el vaso contiguo a ambos lados, si la secuencia no corresponde a los valores de base (en nuestro ejemplo 2.25V) se evidencia un corto circuito. Pero con un poco de práctica esta medición resulta muy práctica para detectar cuando una batería se va a degradar con bastante tiempo de antelación, al poder ver cuando los vasos dejan de cargar de manera homogénea. Actualmente muchas baterías monoblock, se presentan sin estos tapones, así que esta medición –que casualidad- ya no se puede realizar, ni tampoco añadir electrolito para compensar desequilibrios, ni nada… sencillamente dejan de funcionar de la “noche a la mañana” y se tiran. ¿Por qué? En una batería monoblock sobre todo, un sistema de obsolescencia programada muy sencillo (o también en una batería barata con un proceso industrial deficiente sucede lo mismo) consiste en que si se altera mínimamente el proceso de tratamiento de los vasos (basta tan solo de una lámina de plomo o aislante, que es lo más común, de las decenas que contiene), al momento comience a degradarse de manera irregular frente a las demás, los procesos de carga se volverán “aberrantes”, es decir el “reparto” de carga y tensión será incorrecto, por lo que el proceso de degradación y perdida de retención de la carga se acelerará por encima de lo lógico. En el plano teórico una batería debería y perdiendo su capacidad para retener la carga gradualmente pero en la práctica se produce a toda velocidad a causa de este problema. Si estamos empleando acumuladores con vasos separados de 2V (que es lo más aconsejable) para obtener tensiones determinadas más elevadas se conectan en serie: 2Vx6= 12V - 2Vx12=24V – 2Vx24=48V… y así sucesivamente, si queremos aumentar la capacidad además añadiremos vasos en paralelo así para 12V emplearemos (2+2) x6= 24 vasos. Pues resulta muy importante tomar las mediciones de cada vaso independiente para garantizar una carga correcta, pues esta se realiza con una tensión global. Sabemos que la tensión (voltaje de carga) no puede sobrepasar por ejemplo los 14.2V@ 14.6V para un acumulador compuesto de 6 vasos de 2V de plomo-ácido aproximadamente, sin dañar un acumulador pero esto solo se cumple si cada vaso tiene una capacidad idéntica, cuando un vaso se daña comenzará a dañar el conjunto, incluso con deterioros no muy aparentes. Resultado complejo y variable Puesto que el resultado es complejo y variable según múltiples tipos de daño en la batería y el tipo de limpieza realizada, sin proceder a un “desensamblado mecánico”, proseguiremos los experimentos realizados durante un período de varios meses más, aunque es innecesario dilatar más la exposición de este reportaje con un proceso efectivo de reciclado y la base teórica real. Por otro lado continuar las pruebas unos meses más nos permitirá evaluar mejor las curvas de rendimiento y deterioro de estas baterías en diferentes casos, aunque dejamos ya bien claro que hemos podido constatar perfectamente que el resultado es deficiente y aleatorio dependiendo únicamente del estado inicial de la batería y lo enérgica que haya resultado la limpieza con bicarbonato, otras sales o agua destilada.
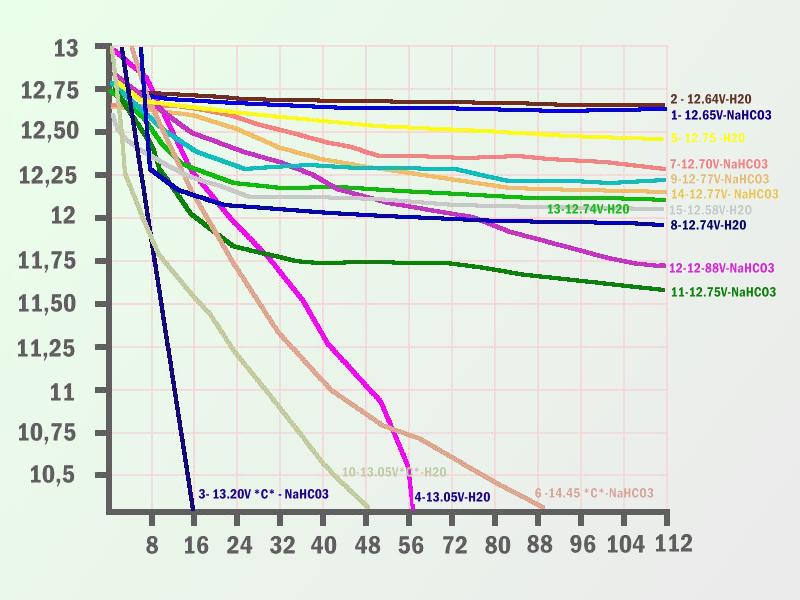
En el gráfico podemos ver el voltaje resultante tras aplicar durante 24h un ciclo de carga con un cargador “inteligente” con una tensión de carga entre 3.8 A y 0.7A que variaba en función de la curva del voltaje de carga y la temperatura de la batería a temperatura ambiente constante de 25º C en las baterías “tratadas” con los supuestos métodos de Internet.
En ninguno de los casos la retención de carga se alteró por el procedimiento y se mantuvo ligada exclusivamente a la tensión inicial y la retención de carga inicial tras el aclarado y relleno con electrolito filtrado, con mejoras exiguas en tan solo cuatro casos de baterías con una retención superior al 70% de su retención inicial de carga teórica y tensiones dentro de un funcionamiento óptimo. Podemos ver la relación entre tensión final en las baterías de 12V tras 10 minutos de final de carga a 112 horas tras un proceso de lavado según el modelo más aproximado descrito en Internet. En varios modelos con igual tensión en cada vaso y un periodo de inactividad similar, sin carga de flotación, se realizo pruebas gemelas con un “lavado” con bicarbonato y otro solo con agua y el resultado fue casi idéntico, apreciándose tan solo algo más de erosión en los vasos donde se empleo bicarbonato, pero no afecto a la retención de carga, en todo caso la empeoró. Se pudo constatar perfectamente la relación entre voltaje final y voltaje inicial (se comprobó previamente que no existieran cortocircuitos). Las pruebas de retención de carga resultaron porcentualmente muy similares. En las baterías que estuvieron más tiempo sin carga de “flotación” la caída de voltaje, retención de carga y destrucción de la estructura interna fueron más evidentes, en el tercer reportaje ofreceremos un punto más extenso respecto a estos factores de deterioro, aunque una batería de 12V por debajo de 10,5V durante 60 días, aunque no contenga cortocircuitos resulta bastante difícil que pueda llegar a retener una carga efectiva superior al 25 – 40% según las pruebas. Tan solo un estado inicial de la batería muy aceptable (retención de 70% de su carga antes del proceso) ha permitido en algunos casos alargar un poco la vida de la batería, pero a un coste inaceptable. A resaltar un caso curioso: dos de las baterías en el rango de 12,20V presentaron corto circuitos tras el ciclo de carga de 24 horas. En el gráfico podemos ver el voltaje resultante tras aplicar durante 24h un ciclo de carga con un cargador “inteligente” con una tensión de carga entre 3.8 A y 0.7ª que variaba en función de la curva del voltaje de carga y la temperatura de la batería a temperatura constante de 25º C Un proceso con un alto coste en agua contaminada Por otro lado se necesita un mínimo de 150grs de bicarbonato u otra sal por batería, (realmente no hemos encontrado ninguna diferencia destacable hasta el momento respecto a una limpieza con agua destilada, como mucho, una aceleración negativa en la pérdida de la capa de óxido esponjoso) Lo peor de los sistemas aconsejados en Internet y con los que hemos experimentado, radica en que se produce un mínimo de 16 litros de agua contaminada con plomo y sales de plomo por cada batería “lavada” y una liberación al medio ambiente a través del desagüe de como mínimo 30 a 150 gramos de plomo y sales de plomo, si se hace un lavado enérgico. Esta es una cantidad enorme y extremadamente peligrosa, suficiente para contaminar miles de litros de agua y muchísimos metros cuadrados de terreno. Si reemplazamos el electrolito deberemos añadir a la ecuación dos litros de ácido sulfúrico tóxico, repleto de plomo. Si lo filtramos, tendremos más residuos tóxicos y contaminantes.
Tan solo una batería de 12V y 70 Amperios contiene de media 2 litros de electrolito compuesto de ácido sulfúrico y agua. Un aclarado con agua exige entre 22 y 30 litros de agua que quedarán completamente contaminados y deberán ser trasladados a un punto de procesamiento, con el consecuente gasto adicional de energía (más polución) o el uso de agua destilada, en cuya fabricación también se emplea energía y puede ser por tanto intrínsecamente contaminante. Todos estos factores deben añadirse al cómputo final de un proceso de reciclado.
Y todo esto hablando solo de baterías “normales” para vehículos de 12V y 70 Amperios, si se realiza este proceso en baterías de camión o acumuladores independientes con vasos de 2V (los más utilizados en estaciones solares) estas cantidades se dispara por 3 o 4 veces más como mínimo. Es decir, empleando la misma cantidad de agua que en procesos más avanzados de limpieza, el nivel de agua contaminada resultante es la misma o más, al no emplear técnicas eficientes. Nos tememos que la mayoría de usuarios que han usado estos procedimientos casi inútiles han vertido el agua por cañerías domésticas contribuyendo involuntariamente a agravar los problemas de intoxicación por plomo locales. Resulta escandaloso ver en muchos de estos vídeos que se difunden por la red como esta agua contaminada se vierte por el fregadero sin escrúpulos ni advertencias del peligro que supone para todos. Queremos dejar claro que toda el agua empleada para las pruebas ha sido procesada y filtrada para posteriormente ser llevada a un centro de reciclado, junto al resto de los materiales resultantes del filtrado y la manipulación de las baterías. Quisiéramos incidir en esta cuestión, pues es un tema difícil de resolver en España, donde tras procesar las baterías, han rechazado los recipientes contenedores del agua resultante en varios centros de procesado o deseaban cobrar en otros por el depósito de las garrafas de agua contaminada, acción ilógica e irresponsable que claramente incitará a muchas personas a “abandonar” los recipientes en cualquier lugar. (Algo que por cierto pudimos comprobar, observando en los alrededores de algunos de estos centros de procesamiento múltiples botellas y garrafas abandonadas con diversos líquidos tóxicos, ¡Algunas de ellas, rotas y esparcidas!) El problema añadido de la reparación de baterías selladas También hemos constatado la gran dificultad de reparar baterías selladas para automovilismo frente a los vasos acumuladores, mucho más fáciles de abrir y volver a sellar. Sin embargo las baterías selladas están especialmente diseñadas en su gran mayoría para quedar completamente inutilizables en caso de intentar repararlas por dos motivos: Primero: desmontar la estructura monoblock obliga en la mayoría de las ocasiones a dejar inutilizable el bloque de material plástico pues se utilizan complejos entramados de sellado que obligarán al uso de nuevos recipientes si no contamos con un equipo de corte y resellado extremadamente especializado que nos obliga al uso de disolventes y productos químicos.
Los grandes acumuladores de 2V muchas veces suelen contener placas y aislantes de tamaños mucho más manejables que facilitan su restauración y no llegan con facilidad a un estado completamente “irreversible”. Si disponemos de los recursos adecuados su reparación es por ello más sencilla, aunque por el peso se hace necesario un buen sistema de anclajes y grúa o un método de limpieza y adecuación con instalaciones amplias o piezas y sistemas especializados para la recogida de los restos tóxicos para procesar.
Este problema no ocurre con la mayoría de acumuladores de un solo vaso, mucho más fáciles de manipular, aunque en los últimos años se constata también en estos un aumento absurdo de la complejidad de la estructura del vaso con el mismo fin (no se nos ocurre otro) ya que la resistencia de las carcasa, sin embargo también se ha visto reducida con el paso de los años. En resumen es un problema de diseño obsolescente sobre todo, pues las baterías se diseñan específicamente para imposibilitar su reparación y procesado sino es para su destrucción y reciclado. A esto contribuye en gran modo unas normas y especificaciones en los modelos de las baterías que sirven de excusa perfecta para compactar altas cantidades de energía en volúmenes de batería muy reducidos en los automóviles. Para poder fabricar baterías de automóvil fácilmente reparables a igualdad de costes de producción, probablemente se debería permitir un 20% de espacio más en el volumen por capacidad admitida. De todas maneras a lo largo de la historia con los volúmenes totales actuales se han construido modelos con mucha facilidad de restauración que sospechosamente han sido abandonados. Hoy en día esta obsesión obsolescente ha llevado hasta el punto de eliminar los tapones para el relleno de electrolito, estructuras monobloque fácilmente deformables con el calor o los impactos que facilitan los cortocircuitos y el empleo de tramas separadoras que se degradan rápidamente.
Abrir una batería de vehículo a 12V puede llegar a ser casi siempre una tarea “infernal” o directamente “misión imposible” por los sistemas de sellado. Por un lado garantizan una manipulación segura y en caso de accidente, suele ser bastante difícil que se derramen si el impacto no es muy violento pero ya no es posible realizar la más mínima incursión dentro de ellas. El primer paso si deseamos entrar en su interior (y conoces toda la normativa de seguridad, la respetas, llevas el equipo necesario, etc, etc…) consiste en cortar con mucho cuidado el ABS alrededor de los bornes. Lo más sencillo es empleando una corona alta para ABS del radio adecuado. Si no, una sierra manual para metal es lo más indicado, con cuidado de rodear los bornes y terminar con un pequeño alicate de punta. (Resulta un proceso difícil y que llenará el interior de restos de ABS). Y esto será solo el comienzo de un proceso casi imposible.
Con los aditivos en el electrolito sucede lo mismo, mantienen el electrolito estable durante un periodo determinado para luego degradarse rápidamente sin razón química comprensible que se pueda prevenir. Por diversas razones de aumento en la supuesta eficacia de la batería, (como explicamos más abajo en el proceso industrial) tanto las placas como los separadores aislantes se diseñan cada vez más delgados, por lo que cuando pasa un determinado periodo de funcionamiento prácticamente “se desintegran” al corroerse, sulfatarse, perder las finas capas de sustrato o “retorcerse” por el diversas razones que hacen imposible su más mínima reparación en un tiempo o coste razonables. Por supuesto nos vemos obligados a decir que todo lo explicado en este reportaje son conclusiones sin constatación definitiva para evitar repercusiones legales en nuestras declaraciones sobre las causas reales de la degradación de las baterías y las razones para construirlas con los métodos actuales. El plomo y sus derivados son altamente contaminantes, el reciclado de una batería es un proceso caro e igualmente peligroso para la naturaleza, pero industrialmente da la impresión que compensa producir baterías nuevas buscando mínimos ahorros que den beneficios al producir millones de unidades y no existir leyes que obliguen a diseños que permitan aumentar su vida y las probabilidades de reparación frente a otros factores privados a corto plazo que dañan terriblemente el medio ambiente y nuestros bolsillos.
Así queda la parte superior de una batería sellada construida con ABS si la intentamos retirar sin dañar el interior, la única opción alternativa es seccionar la parte superior de los bornes.
Procesos químicos esenciales que tener en cuenta Ya tratamos este punto en la primera parte, es algo esencial, pero en este reportaje, por si no has visto el anterior y la química te resulta un poco confusa, vamos a explicar el proceso de dos maneras simplificadas, es exactamente lo mismo, solo que en esta vez y vista la dificultad que tiene que se pueda entender el concepto de “plomo esponjoso” y porqué una batería es un ciclo auto conclusivo, vamos a centrarnos en describirlo de dos maneras diferentes, pero en uno, realizando un símil con el modelo primitivo, el único que realmente se puede reproducir con cierta facilidad y a partir de este intentar mejorarlo según nuestro acceso a tecnología avanzada de reparación. Las reacciones electroquímicas que se presentan en un acumulador son mucho más complejas de lo que se suele explicar, para reparar una batería debemos centrarnos en uno de los modelos más antiguos inventados y base de las actuales baterías de plomo para automóviles como fue el desarrollado por el físico francés Gastón Planté (1859) que es uno de los diseños más antiguos de baterías recargables, según la descripción de Gladstone y Hibbert del año 1890.
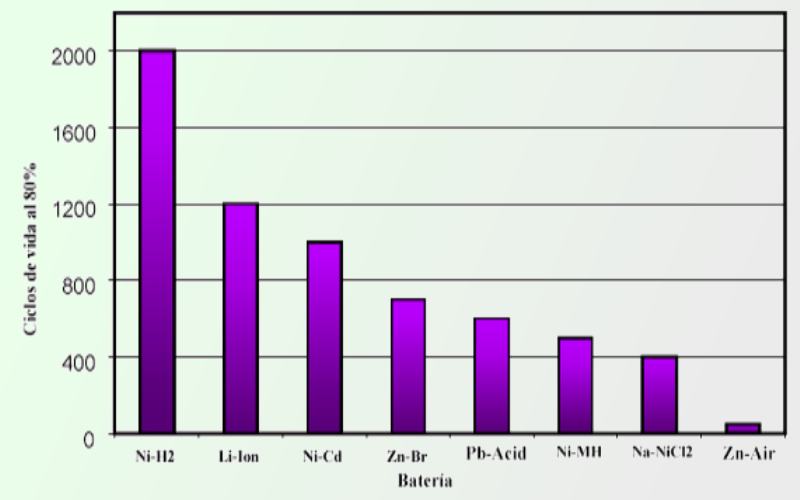
Clasificación de las baterías en función de su ciclo de vida al 80% de retención y descarga a 25ºC. Pese a la pobre retención de carga por volumen y que actualmente se exige en muchas aplicaciones mantener unos niveles de potencia o energía superior con baterías de menor tamaño y volumen, tan solo diferentes modelos basados en formulaciones de Litio han podido competir con esta desfasada tecnología en el mercado de la automoción en los vehículos eléctricos comerciales, suponiendo gran parte del coste del vehículo, cuyo diseño gira en gran parte en torno a las capacidades de este componente.
¿Porqué usar un modelo tan antiguo? Aunque parezca increíble este modelo de diseño tan antiguo es la base de funcionamiento de casi todos los acumuladores comerciales basados en plomo-ácido y una vez se deteriora una batería podemos reducir todas las reacciones a las esenciales, ya que si el acumulador se ha degradado todo se limita a unas placas de plomo separadas por un material poroso pero que las aísla y un conductor iónico o electrolito que emplea una disolución de ácido sulfúrico. Además de un conductor iónico, que será el ácido sulfúrico y agua pura presentado en un determinado rango de concentración (1,24 - 1,32 g/cm3)) necesitamos:
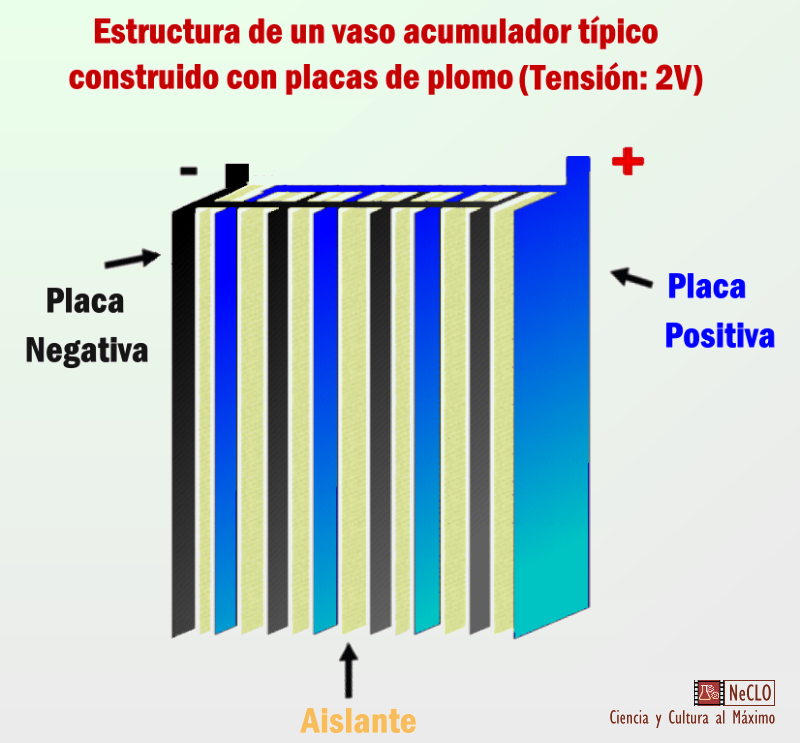
Cada vaso acumulador se compone de varias hojas de plomo separadas por un aislante, formando pares positivo/negativo, así que si estamos hablando de un “solo” vaso acumulador estas placas se conectan en “paralelo” como solo una. A media reducimos el espesor podemos aumentar la superficie en contacto y por consiguiente las prestaciones teóricas de la batería pero según reducimos los espesores se aumenta la probabilidad de una degradación irrecuperable.
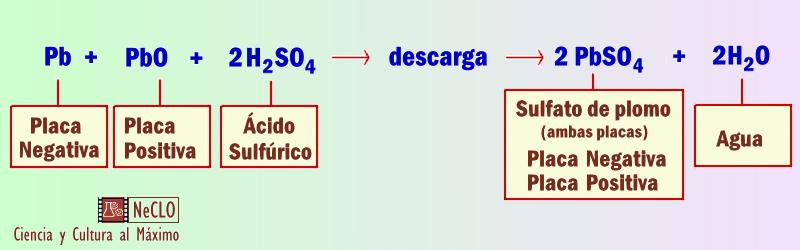
Ahora primeramente entendamos las reacciones que necesitamos conocer para reparar una batería sin cortocircuitos u otros daños físicos: El proceso No debemos olvidar aunque resumamos el proceso a lo esencial que el electrolito (ácido sulfúrico en diferentes concentraciones de 1,24 - 1,32 g/cm3) actúa como conductor iónico y a su vez, interviene en las reacciones de carga-descarga, por lo que actúa también como material activo. Así que las baterías de Plomo-Ácido constituyen un sistema electroquímico complejo con varias reacciones primarias y secundarias, que os dejamos de nuevo primero descritas un poco más ampliamente y luego más resumidas en lo que esencialmente interesa. Proceso de descarga: “teoría del doble sulfato” Ambos electrodos se transforman en sulfato de plomo (PbSO4) con el consiguiente consumo de ácido sulfúrico del electrolito y la formación de agua en el electrodo positivo, por lo que durante la descarga se produce una reducción de la concentración del electrolito y las reacciones transcurren a través de un mecanismo de disolución-precipitación
Proceso de carga
En este se producen las reacciones inversas a las anteriormente descritas, pero además, se producirán reacciones secundarias, cuyos potenciales de equilibrio se encuentran dentro del intervalo de potencial de las reacciones primarias del sistema Pb/PbO2. Por lo que en la fase final de la carga de la batería se produce la evolución de oxígeno e hidrógeno por electrolisis: Electrodo negativo Tiene lugar la evolución de hidrógeno y la reducción de oxígeno.
Electrodo positivo
Se produce la evolución de oxígeno, y al valor del potencial del electrodo positivo, el plomo se puede oxidar a PbO2 formando una lámina protectora sobre el sustrato de plomo, es decir que hablamos de corrosión.
Recombinación o ciclo del oxígeno
En las baterías selladas o reguladas por válvulas se emplean mecanismos internos que minimizan la generación de Hidrógeno y Oxígeno, reduciendo la pérdida de agua por electrolisis. Aquí el oxígeno generado en la sobrecarga del electrodo positivo se transforma de nuevo en agua mediante una serie de reacciones químicas y electroquímicas que tienen lugar en el electrodo negativo.
Y por tanto:
Y al final se produce el proceso de auto descarga donde pierde la capacidad si no aplicamos una corriente externa. El PbO2 y el Pb, que son termodinámicamente inestables en medio ácido a circuito abierto, reaccionan con el electrolito, de tal manera, que se genera oxígeno en el electrodo positivo e hidrógeno sobre el negativo, en función de la temperatura y la concentración de ácido.
Realmente el proceso aún podemos resumirlo más si queremos comprender las fases que debemos controlar, así que si no lo has comprendido, te lo dejamos ahora más simplificado: Inmersión Inicial Cuando sumergimos dos placas limpias de aleación con base de plomo (a partir de ahora lo llamaremos solamente “plomo”) la combinación del plomo con el electrolito compuesto de ácido sulfúrico y agua pura (destilada) produce inicialmente: Oxidación del plomo a nivel superficial a sulfato de plomo (PbSO4). Aplicación Inicial de corriente Si aplicamos posteriormente corriente eléctrica entre las placas; Se produce electrólisis, dando lugar a estas reacciones químicas:
Aplicación Inicial de corriente, segunda interacción Esto a su vez genera: Dióxido de plomo (PbO2) en la placa positiva Pérdida de electrones en la placa negativa, (de aquí recibe el nombre de “plomo esponjoso”). Proceso de descarga La reacción en las placas por tanto se puede reducir al siguiente esquema, donde en el lado izquierdo vemos la distribución química con carga y a la derecha el resultado inicial de la oxidación.
Proceso de carga
Tras una fase inicial (que es la que nos interesa reproducir a la hora de restaurar una batería el proceso de carga de una batería si las reacciones anteriores se han producido correctamente) se hace fluir corriente eléctrica entre ambas placas de plomo con sus respectivos depósitos ya creados en la superficie de las placas. Así que el resultado es:
Es más sencillo así, ¿no?
En un gran acumulador todas las piezas se montan con unos grosores y distribución que permiten más fácilmente su restauración y en el caso de modelos con carcasas transparentes como la de la imagen se pueden observar con facilidad los efectos de la degradación antes de considerar su manipulación.
¿Cuál es el problema? Se puede resumir en que la vida útil es corta porque con el paso del tiempo el agua se descompone en gases (Hidrógeno y Oxígeno) y el ácido sulfúrico se convierte en sulfato de plomo. (Que es tóxico y corrosivo por inhalación, ingestión o contacto, además de acumulativo en el organismo). Las reacciones químicas producen compuestos químicos no deseados y la descomposición del plomo esponjoso en la placa positiva, esencial para el correcto funcionamiento. El electrólito se corrompe con la acumulación de moléculas de otros compuestos químicos no deseados que poco a poco influyen en la reacción química. Los elementos aislantes se degradan por acción química, mecánica y la temperatura. El exceso de temperatura y otros factores puede deformar las placas y crear cortocircuitos. La aparición de sulfatos por todo el circuito degradará la función electro química. Podemos profundizar en los procesos de degradación en otro reportaje pero de momento para nuestro propósito de restaurar una batería lo dejaremos aquí por hoy. Diseño resultante a conseguir Al diseñar un proceso para restaurar una batería se busca una tensión final en la bateria cargada de por lo menos 12,72 V en el caso de una batería de 12V que cumpla los requisitos para poder ser cargada con dispositivos electrónicos estándar para baterías de plomo.
Las placas de ABS que atraviesan de lado a lado una batería y separan los diferentes vasos (en total 6) son selladas a la tapa superior, haciendo casi imposible un desensamblaje sencillo, pero esto empeora porque tampoco es posible quitar la carcasa inferior en muchas baterías porque normalmente las conexiones atraviesan las tapas separadoras uniendo los bornes de cada vaso así que no hay vía posible para desmontar las piezas y limpiar mecánicamente las placas o reemplazar los aislantes.
Así que en este caso debe estar constituido por 6 celdas o vasos que alcancen un voltaje simultáneo una vez cargados de 2,12 V respectivamente. Si hablamos de una batería de 24 V, el resultado debe ser 2,12V x 6= 25,44 V repartidos correctamente en 12 vasos dentro de un rango de: 2,120V a 2,124V aproximadamente. A medida que la tensión final conjunta en los vasos se aleje de este rango, el proceso de degradación se acelerará rápidamente. ¿Esto qué quiere decir? Quiere decir que cuando una placa o vaso se deteriora, es metafóricamente como si fuera más pequeña, por tanto se cargará antes que un vaso en mejor estado y alcanzará antes la tensión final de 2,12V. Aquí radica un serio problema porque el cargador continuará suministrando una tensión conjunta equivalente a la suma de todos los vasos, sin ser consciente de que se debe detener en un vaso determinado, provocando reacciones químicas indeseadas que dañaran el vaso y un aumento del amperaje suministrado al resto de vasos que podría superar el admisible deteriorando también los vasos. Si por ejemplo empleamos para cada vaso un cargador independiente que suministre una tensión entre 2,32V y 2,45V controlando electrónicamente también el amperaje, este problema no se provoca o es menos grave, pero es un sistema bastante complejo y poco eficiente en la práctica que obliga a un sofisticado y caro sistema de conexiones y desconexiones de las terminales, aunque garantiza un control y monitorización absoluto de los vasos que previene y alarga la vida de los acumuladores y que sería el modelo ideal de carga, aunque por desgracia no es viable económicamente en sistemas comerciales para vehículos o acumuladores solares por ejemplo, por lo que por desgracia no se utilizan.
Las variaciones en el color en las piezas de contacto que a su vez hacen de polos positivos y negativos que interconectan en serie los diferentes recipientes contenedores, variarán según correspondan al polo positivo o negativo, pero si encontramos otras tonalidades que no sean las dos únicas y lógicas, será señal de una degradación profunda y la pérdida del plomo esponjoso.
¿Qué es la “ECUALIZACION”? Supongo que muchos de nuestros lectores habrán escuchado este término anteriormente, pero existe cierta confusión sobre su uso real. Esto es debido a que se explica de muchas maneras y pocas son correctas. Se puede encontrar en Internet en mil sitios, pero hay como siempre respuestas contradictorias y muchas tonterías destinadas únicamente a atraer público a un sitio, pero, hasta donde se ha podido constatar en pruebas rigurosas de laboratorio, por desgracia, la ecualización solo permite alargar la vida y la capacidad de retención de carga de una batería en buen estado. Es posible encontrar en Internet anuncios falsos de vez en cuando donde cuentan que se pueden reparar baterías completamente agotadas o inutilizables en Internet, pero es simplemente: MENTIRA Solo un milagro puede reconstruir una place de plomo o aislante que se ha desintegrado, así que se prudente si te dispones a gastar el dinero en un cargador que disponga de esta supuesta función milagrosa. La ecualización de acumuladores, sobre todo en energía fotovoltaica, tiene como objetivo aprovechar al máximo la capacidad de carga de un acumulador de gran tamaño, alargando la vida útil de ése, así como su eficiencia y capacidad de retención de carga. El proceso para ecualizar acumuladores debe realizarse regularmente, bajo supervisión de alguien que conozca perfectamente el proceso. ¿Por qué? Es un proceso muy delicado, durante el cual estamos realizando una sobrecarga controlada de tensión sobre nuestra batería y por tanto, tendremos que tener en cuenta una serie de precauciones muy especiales de las cuales dependerá que no dañemos nuestros equipos Cuando se carga una batería, como ya hemos explicado, el sulfato que contiene la placa se libera en el electrolito formando ácido sulfúrico, quedando el plomo en la placa. Pero cuando la batería está haciendo su función, sucede lo contrario. Ahora bien, lo que ocurre es que en cada ciclo de carga y descarga de la batería, hay una pequeña parte del sulfato que se queda en la placa y llega el problema. Este sulfato de plomo se irá cristalizando y provocará que la capacidad del acumulador se reduzca, haciendo que cada vez sea menos eficiente, hasta que el acumulador quede inservible. Normalmente este proceso se “adelantará” en uno de los vasos al resto del conjunto, acelerando más el deterioro que si se produjera de manera homogénea en todos los acumuladores del sistema. Cuando sucede, si el deterioro ha sido grave, será imposible poder ecualizar de nuevo nuestros acumuladores. Otro de los efectos negativos que surgen durante la vida de un acumulador es que el electrolito tiende a dividirse en capas de ácido y agua. Cuando estos componentes se separan, provocan que en la parte alta se concentre más agua mientras que en la parte inferior lo haga el sulfuro, desequilibrando las reacciones en el acumulador. Cuando se realiza un proceso de ecualización, el voltaje aumenta en aproximadamente 2.5 voltios por cada celda (puede ser que el dispositivo ofrezca el voltaje a 2.60 V/celda a 25ºC no existe un valor único que podamos unificar) Eso significa: En una batería de 12V alcanzar 15V En una batería de 24V alcanzar 30V En una batería de 48V alcanzar 60V Hay que asegurarse también que la corriente en dirección a los acumuladores no exceda nunca el 5% de la capacidad total. O sea, que si tenemos un sistema de acumuladores de 300Ah no debe circular una corriente mayor a 15Ah durante el proceso de ecualización, el cual provocaría un sobrecalentamiento fatal de los acumuladores. Como ejemplo (tengamos en cuenta que los valores cambian con cada fabricante) si tenemos unos acumuladores con una densidad de 1,20 gr/lt y medimos otros con 1,24 gr/lt , deberíamos realizar una ecualización. Es difícil encontrar el tiempo exacto, como orientación podríamos decir que unas 4 horas por ciclo es lo recomendable para la mayoría de casos pero lo correcto durante la ecualización es comprobar los cambios en la densidad cada hora y desconectar la carga cuando la densidad ya no sube más. Este es el momento en que por más que ecualicemos no obtendremos más ganancia y continuar cargando produciría una corrosión dañina. Hay que estar pendientes que la batería debe mantenerse fresca y bajo vigilancia durante la ecualización y no debe llegar a 45 grados o vigilar los niveles de electrolito ya que este proceso produce un consumo más elevado del habitual. Cuando elevamos la tensión durante el proceso de ecualización, el sulfato que se está cristalizando en las placas tiende a combinarse con el electrolito, convirtiéndose de nuevo en ácido sulfúrico, precipitándose hacia la parte inferior, así conseguimos que las placas se limpien exponiéndose plomo nuevo frente al electrolito. El resultado es que por ello recuperamos capacidad en nuestra batería.y alentamos un proceso en el que el ácido se recombina con el agua en el electrolito de forma regular reduciendo la estratificación. No existe un valor exacto acerca de cuándo tendremos que ecualizar una batería, ya que depende de los diferentes modelos (hay que consultar las especificaciones del fabricante) pero lo normal viene a ser entre 10 y 12 ciclos de descarga completa (algo teórico, ya que no debemos alcanzar ese grado de pérdida de ionización en las placas). Así que lo normal en un uso habitual, por ejemplo, en energía solar o eólica puede ser de 2 o 3 ecualizaciones al año, una más si el uso es intensivo y nos aseguramos de que no es incompatible con los aditivos del modelo de acumulador. Una de los problemas más frecuentes que se suelen dar al ecualizar un acumulador es que alguno de los vasos comiencen a burbujear y salpicar durante el proceso o una vez finalizada la carga. Esta situación puede decirnos que se está produciendo un cortocircuito y tendremos que desconectarla inmediatamente del sistema de acumuladores a la espera de que la temperatura se normalice. En ese momento deberemos de verificar el acumulador con un medidor de densidad. Una vaso en cortocircuito nos dará un valor mucho menor que un otro en buen estado. Si esto sucede habría que reemplazarlo (o restaurarlo –cuestión difícil como llevamos explicando) En definitiva una carga de ecualización no es nada más que una sobrecarga forzada que elimina la sulfatación de la batería que pueda haberse producido durante las condiciones de carga baja. Incluso los propios fabricantes de acumuladores de alto costo la recomiendan para evitar la sulfatación que sucede cuando las densidades de los elementos tengan diferencias remarcables entre vasos. Proceso industrial de adaptación de las placas Ahora que ya te vas haciendo una idea de como son las reacciones químicas que intentas realizar y los difíciles vías par una solución, te vamos a explicar las fases más significativas y comunes que suelen encontrarse en una batería de plomo ácido. Conocerlas te permitirán llegar mucho más allá si decides estudiar el proceso a fondo y deseas construir tus propias estructuras desde cero, para ello usa estos conocidos esquemas de fabricación como referencia y busca información (aunque sale de los objetivos de este segundo reportaje fabricar las placas, sí necesitas entender el proceso, tanto si las construyes desde cero o necesitas comprender el problema de la restauración de sus propiedades en un acumulador deteriorado) La parte física es sencilla, pues se limita a procesos correctos de fundición, pero la adecuación de la composición química y evitar la degradación o corrosión de las placas es más complicada, Para comenzar necesitamos plomo, mucho plomo, tanto para la rejilla como para preparar los materiales activos se usa este material, que debe ser de alta pureza para impedir la contaminación de la batería. Este plomo es oxidado por dos procesos diferentes conocidos como “Barton / pot” y “ball mill”. En el primer método el Pb fundido se oxida con aire y en el segundo se muele por impacto y cizallamiento en una atmósfera de aire, pero ambos procedimientos, el material obtenido (óxido de plomo o “leady oxide”) es una mezcla realmente de PbO tipo litargirio (es decir, fase tetragonal) y partículas de plomo cuyo tamaño de partículas depende del tipo procesado en el molino, aunque son todas de tamaño micrométrico. Por otro lado el número de partículas de plomo que permanecen sin oxidar por ambos métodos es del 15 al 30 %.. La oxidación de este plomo tiene lugar durante la etapa de curado de la rejilla empastada. Aunque el componente activo de ambos electrodos es el mismo, suelen prepararse por separado, ya que la placa negativa precisa de una serie de aditivos tales como el sulfato de bario, ligninas orgánicas, lignosulfonatos, negro de carbón o de humo como materiales activos secundarios. Además actualmente, se han desarrollando nuevas tecnologías aún más complejas para obtener materiales activos que permiten alcanzar mayor capacidad y duración en la vida de la batería. Cabría destacar los materiales nanoestructurados que muestran un desarrollo electroquímico aceptable, alta capacidad específica y buen comportamiento de ciclado. Preparación de la pasta Este es el primer paso para conseguir el material electroquímicamente activo de la batería y consiste, básicamente, en mezclar homogéneamente el material de base que generalmente es “óxido de plomo”, entendido como lo que antes hemos explicado con agua y ácido sulfúrico (H2SO4). La misión de esto es preparar el material activo de forma reproducible y que tenga humedad suficiente para realizar la etapa de curado con éxito, una textura y composición uniforme, así como buenas propiedades plásticas. Curado Luego llega la etapa más larga de todo el proceso, que es la de curado, viene a durar aproximadamente entre 48 y 72 horas donde hay que calentar los electrodos bajo humedad controlada. En este proceso se diferencian tres fases a su vez: Primera fase: “Hydroset” Aquí hay un secado superficial de la pasta inmediatamente después del empastado para igualar la humedad de todas las placas y evitar que se “peguen”. Segunda fase: Tratamiento a temperatura controlada y 100 % de humedad para provocar la oxidación del plomo libre que quede en las placas. En esta etapa también se recristalizan los sulfatos básicos y se provoca la corrosión superficial de la rejilla para mejorar el contacto entre la pasta y la rejilla. Tercera fase: Proceso de secado para reducir el contenido de agua a un nivel mínimo necesario para que el material activo tenga buena estabilidad. Así una vez que las placas están curadas, pueden ser almacenadas durante bastante tiempo sin que se alteren sus propiedades. Algunas tecnologías más actuales tienden a suprimir o minimizar esta etapa para simplificar el proceso de fabricación, y reducir los costes y el tiempo de producción. Producción de los electrodos Este es el último proceso esencial dentro de la fabricación de una batería. En este proceso los óxidos de plomo y sulfatos básicos de la pasta curada son electroquímicamente transformados en material activo, dióxido de plomo (PbO2) para la placa positiva y plomo “esponjoso” (plomo metálico) para la negativa. Hay que tener en cuenta que cuando estos componentes activos son preparados por métodos químicos, la capacidad que desarrollan es muy baja. La naturaleza del material activo ha de tener una micro estructura que se consigue mediante una compleja combinación de reacciones químicas y electroquímicas que tienen lugar durante el proceso de formación. Los factores más decisivos que influyen en la formación de la materia activa son:
Con el paso del tiempo y con el objetivo de alcanzar los requerimientos de energía y potencia cada vez superior solicitada en los vehículos modernos se están modificando continuamente los diseños de la producción de una batería eliminando el exceso de plomo inactivo, usando por ejemplo placas más delgadas o disminuyendo el peso por utilización de rejillas de menor grosor, mejorando el funcionamiento de las baterías que trabajan a carga parcial. En teoría se busca que el diseño de las celdas ofrezca unas características de carga y descarga más uniformes minimizando la corrosión entre las rejillas y acortar las distancias de difusión mejorando el funcionamiento de la celda y conseguir una mayor utilización de la materia activa. En siguientes reportajes continuaremos explicando el resto del proceso industrial pero dada la extensión creo que ya ha quedado clara la explicación que se suele ofrecer sobre la complejidad de los sustratos con los que una batería actual es tratada y la dificultad para reproducirlo- ¿Complicado verdad? Bueno, podemos resumir que en las cadenas automatizadas de fabricación de baterías de plomo, el dióxido de plomo y el plomo esponjoso que recubre las placas de plomo se prepara de muy diversas formas y no es un proceso que podamos reproducir en pequeños talleres de forma eficiente ni barata para una cantidad limitada de acumuladores. Simplemente resulta imposible.
Si observamos con detenimiento las diferentes láminas observaremos como al ser tan delgadas tanto plomo como aislantes se han degradado hasta descomponerse y soltar depósitos entre las placas, pero además podemos observar peligrosas torsiones en los paneles fruto de la temperatura y las reacciones químicas, esto segundo NUNCA debería ocurrir en un buen diseño, pero son las consecuencias comunes en los rápidos procesos de degradación.
La complejidad en el diseño de las celdas empeora el problema de reciclado, así que cuando a continuación se procede al intercalado de los separadores y la unión de placas positivas y negativas en un mismo “bloque” su posterior separación y recomposición se transforma en una tarea casi imposible. Esto puede hacerse o bien uniendo dos grupos de placas de plomo positivas y negativas ya tratadas o conectándolas tras el intercalado. (Lo cual dificulta enormemente una separación posterior para su procesado) Los actuales paneles separadores porosos se diseñan muy frágiles de por sí, extremadamente difíciles de separar o con formas en el diseño de las placas que hace muy difícil insertar unos nuevos a un coste y tiempo razonable. En teoría estos diseños deberían aumentar la superficie y el rendimiento aunque la observación detallada de la mayorías de los diseños parece más encaminada a impedir una sustitución sencilla (aunque esto es de nuevo una deducción que podría se errónea y puede atender únicamente a la eficiencia y ahorro extremo de los costes de producción, pero si medimos el peso, eficiencia y capacidad de carga en los últimos años ha variado más bien muy poco frente a la tremenda complejidad que han adquirido en el diseño) Todo se limita a limpiar las placas ¡Una batería bien cuidada suele morir por shedding (desgaste de placas) o sulfatada y luego el deterioro acaba en desgaste, quien afirme que la sulfatación es la causa principal frente al Shedding, primero que mire el interior de unas cuantas baterías degradadas y estudie las rejillas en los primeros polos donde se inició la degradación antes de opinar! Así pues, todo se limita a un reinicio, es decir:
En consecuencia resulta teóricamente un proceso sencillo si no fuera por las fases de desensamblaje y ensamblaje de los módulos de baterías y el alto coste medio ambiental.
En muchos modelos actuales de baterías para vehículos la unión de los polos positivos y negativos atravesando por diversos puntos las láminas laterales de ABS imposibilita casi completamente sacar las láminas en buenas condiciones para poder tratarlas sin romper casi por completo cualquier pieza.
Ahora una reflexión antes de seguir Sabemos que el ácido sulfúrico puro (H2SO4) tiene una densidad 1.84g/ml y un electrolito con densidad 1.28g/ml (SOC 100%) es ácido sulfúrico diluido en agua, con una concentración de 34% en peso. Así, con la batería descargada (SOC 0%; densidad 1.08g/ml), la concentración es de 9% en peso. ¿Qué pasa si sustituimos el electrolito con densidad 1.08g/ml en un vaso descargado por electrolito con densidad 1.28g/ml? Parece que tendremos un vaso aparentemente bueno, con la densidad perfecta, ¿no? Pero si medimos la tensión, veremos la realidad: Será menor de 1.90V y si intentamos cargar el vaso, apenas se notará efecto comprobando que el vaso apenas tiene capacidad. ¿Por qué? Aumentar la concentración del ácido si el vaso esta descargado,(o sea no se ha producido el diferencial iónico en las placas), simplemente habrá demasiado ácido sulfúrico en el vas que encima dificultara las reacciones químicas. Tan solo con esta manipulación hemos convertido un vaso en un mero recipiente con electrolito, ya no es un acumulador. La tensión eléctrica en una batería, no está causada por la densidad del electrolito, sino por las reacciones químicas que ocurren durante la descarga. En estas reacciones redox se liberan electrones, que son los responsables de la tensión. Si la batería está dañada o sulfatada, no debemos manipular la densidad del electrolito, tenemos que conseguir que las reacciones redox vuelvan a funcionar correctamente y como mucho ajustar la densidad a la más aproximada respecto a la carga real de la batería. Elección de los materiales aislantes y selladores El grado de dilución correcta del electrolito, los materiales a emplear en el aislante y la adecuación de la cubeta final y el resellado de los vasos es un problema delicado, así que en esta primera parte del reportaje vamos a comenzar por aquí, porque si no podemos “desmontar” y “volver a montar” la batería de poco va a servir nada que hagamos con el proceso químico. Creemos que resulta imposible resellar una batería de automóvil una vez desmontada dada la distribución de las placas, lo que obliga a que permanezca más o menos abierta. Así que nos podemos olvidar de volver a usarla en un vehículo, sin conocimientos avanzados en resellado de ABS o cambiando completamente el bloque original por otro a un coste aceptable, algo casi imposible. Tema bien distinto es emplearla como un acumulador estático, por ejemplo en energía solar. Aquí el problema se resuelve y con los vasos independientes resulta mucho más sencillo todavía, tanto de desmostar como de reciclar. Los aislantes que habitualmente se intenta emplear en este tipo de reciclados son:
La fibra de vidrio es muy resistente al ácido sulfúrico, pero tenemos que tener en cuenta que existen diversos tipos: Clase A. A-glass: vidrio alcali-cal con pocos o ningún óxido de boro Clase C C-glass: vidrio álcali-cal con alto contenido de óxido de boro, usadas por ejemplo en fibras de vidrio con filamentos cortos Clase D. D-glass: vidrio de borosilicato con una constante dieléctrica alta Clase E, la más común. E-glass: vidrio de alumino-borosilicato con menos de 1% peso de óxidos alcalinos, principalmente usada para Plástico reforzado con vidrio, Clase E-CR. E-CR glass: de silicato álcali-cal con menos de 1% peso/peso de óxidos alcalinos, con alta resistencia a los ácidos. Clase R R-glass: vidrio de alumino silicatos sin MgO ni CaO con altas prestaciones mecánicas Clase S S-glass: vidrio de alumino silicatos sin CaO pero con alto contenido de MgO con alta resistencia a la tracción
Son polímeros que contienen enlaces de tipo amida. Existen muchas variantes, las poliamidas se pueden encontrar presentes en la naturaleza como la seda o también sintéticas, como es el caso del Kevlar, el Nylon o el Nomex, así que pueden tener propiedades muy diferentes, por ejemplo, las soluciones diluidas de ácidos afectan ligeramente al “Nylon 6” y las soluciones concentradas en caliente de ácidos inorgánicos destruyen al nylon. Las soluciones concentradas en frío del ácido sulfúrico y nítrico disuelven el nylon.
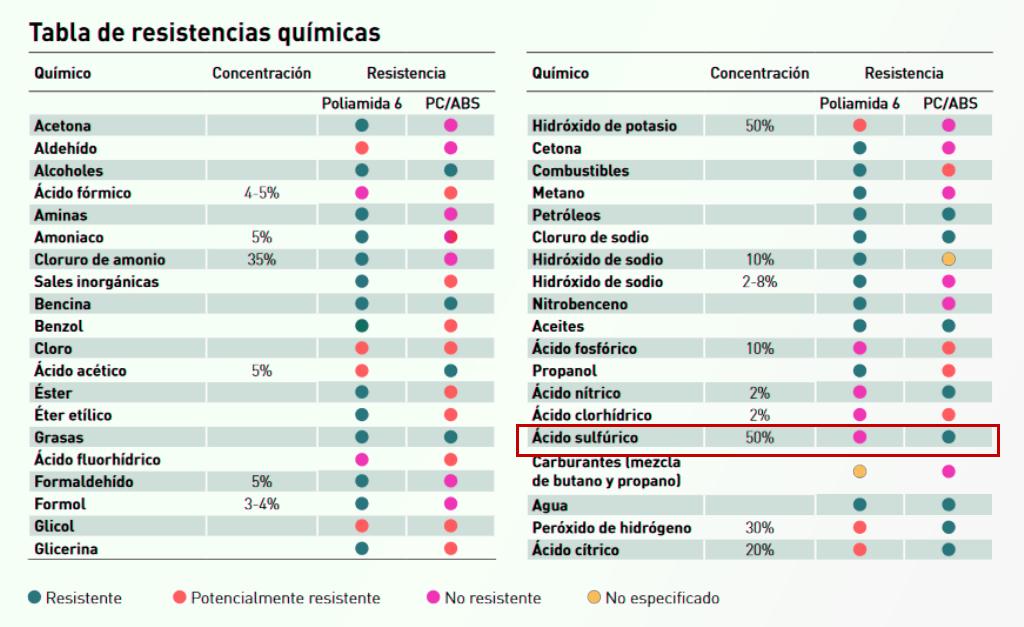
Tabla comparativa de resistencia de la Poliamida 6 frente al ABS, material realmente resistente a las diluciones habituales de ácido sulfúrico.
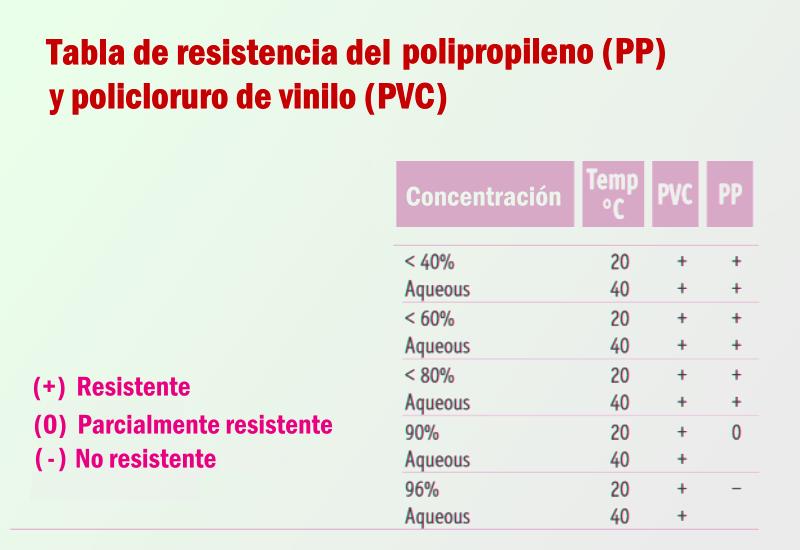
El acrilonitrilo butadieno estireno, conocido por por sus siglas en inglés ABS (Acrylonitrile Butadiene Styrene), Es un termoplástico amorfo, muy resistente al impacto (golpes) y empleado en todo tipo de productos industriales o domésticos, pero es un plástico cuya elaboración y procesamiento es mucho más complejo que los plásticos comunes y más difícil de manipular a nivel doméstico pero proporciona rigidez, resistencia a ataques químicos y mucha estabilidad a altas temperaturas. Es un material presente por doquier, se puede usar en aleaciones con otros plásticos. Así por ejemplo, el ABS con el PVC da un plástico de alta resistencia al fuego o también se le puede añadir PTFE (teflón) para reducir su coeficiente de fricción o compuestos halogenados para aumentar también su resistencia al fuego. Su gran resistencia viene del uso combinado de sus tres componentes que da como resultado muchas variantes, algunas incluso se pueden cromar y revestir con una capa metálica. Se emplea ampliamente para la construcción de los recipientes de las baterías, es realmente resistente “a todo”, así que el material no es el problema, si no que viene de la manera en que son selladas, que obliga a destruir literalmente el contendor, imposibilitando el resellado a no ser que tengamos un dominio aceptable del sellado con disolventes, el termo sellado y la maquinaria adecuada para ello. El ABS es el material ideal para los recipientes de las baterías, pero se requiere de maquinaria especial y productos químicos especializados para poder manipularlo adecuadamente o poder sellarlo, aunque existen cubetas con cierre por juntas y a presión que se pueden adaptar pero una vez más disparan el presupuesto. En el caso de cortar vasos acumuladores únicos, es decir de 2V, normalmente el resellado puede resultar bastante sencillo, aunque es necesario el uso de disolventes especializados. Por mucho que pensemos que servirá un adhesivo doméstico para PVC este no es válido.
Es un material perfectamente compatible y resistente. Químicamente es un polímero vinílico (cadena principal formada exclusivamente por átomos de carbono) y en particular una poliolefina. Ha sido uno de los plásticos con mayor crecimiento en su producción en los últimos años frente a los otros principales termoplásticos (PE, PS, PVC, PET) así que resulta muy sencillo de encontrar y fabricado casi en infinidad de modalidades, así que es conveniente conocer someramente los diferentes tipos: Tipos: PP homopolímero Se denomina homopolímero al PP obtenido de la polimerización de propileno puro. Según su tacticidad, se distinguen tres tipos:
PP copolímero Al añadir entre un 5 y un 30% de etileno en la polimerización se obtiene un copolímero que posee mayor resistencia al impacto que el PP homopolímero. Existen, a su vez, dos tipos:
Cuando el porcentaje de etileno supera un cierto valor, el material pasa a comportarse como un elastómero, con propiedades muy diferentes del PP convencional. A este producto se le llama caucho etileno-propileno (EPR, del inglés Ethylene-Propylene Rubber). Terpolímero EPDM. Cuando se agrega un tercer componente del tipo dieno (Butadieno, por ejemplo) el resultado es un elastómero o hule de Etileno-Propileno, denominado EPDM.
Aislantes con fibra de vidrio y propileno
Resultará fácil sustituir como aislante tramas de fibra de vidrio o propileno que hayamos comprobado durante 15 días que no degradan a una concentración de ácido sulfúrico del 30%. Dada la increíble cantidad de combinaciones que existen aconsejamos siempre sumergir el material en una cubeta de electrólito a una temperatura de 30ºC o 35ºC durante un mínimo de este tiempo para garantizar la resistencia. Nos asombramos de la cantidad de variantes de tejidos de fibra de vidrio y propileno que se degradaron en las pruebas pese a las afirmaciones de los fabricantes. Al final no dejo de ser una experimentación de prueba y error. Esta prueba resulta crucial, una vez hemos aplicado el aislante tejido poroso, es muy importante que no degrade pero que las características físicas del material no dificulten el contacto del electrolito con las placas. Si no nos aseguramos veremos que debido a que la superficie no es lo suficientemente porosa que permitan el paso del electrolito, las placas se encontraran demasiado “secas” impidiendo la carga correcta de los vasos, produciendo una resistencia interna lo suficientemente alta para imposibilitar la carga. La importancia de la configuración de la malla y los factores de auto-descarga Si la capacidad de retención de la carga de nuestra batería es insuficiente, puede se probablemente debida a la pérdida del recubrimiento de peróxido de plomo en las placas positivas, pues sucede cuando este se pierde. Si empleamos una malla burda en las placas propiciaremos que el peróxido formado en las celdas positivas se pierda, precipitándose al fondo del contenedor. Está claro que el nivel de auto-descarga de una batería depende de varios factores, así que estos son los que debemos tener presentes al reparar una batería principalmente:
Normalmente aunque realicemos todo correctamente la pérdida de carga se deberá principalmente a dos razones: El aumento gradual del desequilibrio en la tensión de los distintos vasos que aumentará con los ciclos por pequeñas diferencias en la retención de carga. (Algo que no ocurre de la misma manera en los vasos con carga independiente) La elección de los materiales aislantes, composición y forma, siendo ambos factores cruciales. Soldando ABS: Soldadura por disolvente Por muy bien que desmontemos nuestro recipiente de ABS vamos a necesitar reacondicionarlo si deseamos volver a utilizarlo y probablemente construir incluso una tapa nueva partiendo de hojas de este material. Taladrarlo o cortarlo es relativamente sencillo pero el sellado no tanto, así que recurrir a la soldadura por disolvente, un método donde se aplica un disolvente que pueda disolver temporalmente el polímero a temperatura ambiente. Cuando hacemos esto las cadenas de polímero son libres de moverse en el líquido y pueden mezclarse con otras cadenas disueltas de manera similar en la otra pieza. Es un sistema lento, pero si se le da suficiente tiempo, el disolvente se evapora, de modo que las cadenas pierden de nuevo su movilidad. Esto deja una masa sólida de cadenas de polímero entrelazadas que constituye una soldadura. Esta técnica se utiliza comúnmente para la conexión de piezas de PVC y ABS, como en las tuberías o la reparación de muchas piezas plásticas. Hay una amplia lista de disolventes: acetato de butilo, acetona, cloroformo, ciclohexanona, dicloro etano o tolueno capaces de disolver muchos materiales plásticos, aunque es la acetona la más empleada para la soldadura de piezas de ABS y puede suministrarse en compuestos gelificados para estos usos, aunque son compuestos caros, a veces difíciles de conseguir sin ciertas licencias o en algunas regiones. Filtrado y neutralización del ácido sulfúrico Como se ha comentado el electrolito es una mezcla de agua y ácido sulfúrico donde continuamente se irán añadiendo otras impurezas, y no solo plomo, sino toda clase de compuestos con los que habrán sido tratadas las placas en el proceso de fabricación y el recipiente de ABS. Estas partículas son muy difíciles de eliminar así que lo ideal sería poner electrólito limpio, que es una mezcla que podemos comprar en almacenes de repuestos para coches (no franquicias, tiendas de “marcas”, ni grandes superficies) o suministradores de productos químicos. No suele ser muy caro, porque es un producto químico industrial muy común, pero en pequeñas cantidades está aumentando su precio porque cada vez se vende menos para baterías, así que en algunas zonas es más fácil comprar ácido sulfúrico para otros propósitos y obtener la densidad adecuada, mezclándolo con agua destilada.
Emplear un buen densímetro para comprobar la mezcla del electrolito es algo esencial, aunque hay costosos aparatos para laboratorio se venden económicos aparatos para medir ácido sulfúrico en acumuladores, cuanto más precisa la escala mejor (el del centro sería el más aconsejable y olvidemos el remarcado, que es lo que normalmente encontraremos en grandes superficies y franquicias de recambios de coche)
Un método simple de conseguir ajustar bien la disolución es con un densímetro, como el que podemos ver en la imagen inferior o emplear uno específico de laboratorio o adquirir uno para medir la concentración de electrolito de los que se venden en tiendas especializadas de automoción, baterías o energías renovables. La otra solución más barata y sencilla (pero que provoca restos contaminantes) consiste en filtrar el electrolito.
Método básico para el filtrado del electrolito
La manera más sencilla es colocar un embudo y poner un trozo a presión de algodón, luego vamos vertiendo el ácido sucio, poco a poco y al cabo de unas 8 horas podemos filtrar los 2 litros aproximadamente de ácido sulfúrico que contiene una batería de 70 Amperios, aunque esos residuos recogidos luego deben ser llevados en su totalidad a un centro de reciclado, incluyendo los envases o recipientes empleados, el algodón y el agua empleada para la limpieza de todos los instrumentos usados. Este método, aunque veamos un líquido cristalino aún contendrá muchísimas impurezas, podemos mejorarlo colocando el líquido en una serie de recipientes y previo decantado del ácido, usar cartuchos especiales de 5 micras y 1 micras sucesivamente y hacer pasar el líquido, pudiendo retener partículas solidas constituidas por los metales presentes como hierro, antimonio, selenio, además de plomo y otros sulfatos para luego ser llevados a reciclar. (Lo lógico sería luego llevar esos cartuchos de filtrado resistentes al ácido a una fundición junto con el resto de la escoria y desechos). Para la reconstrucción de una batería basada en placas “limpias” que se deban cargar inicialmente para desarrollar los sustratos correspondientes de Dióxido de Plomo (PbO2) en la placa positiva y Plomo Esponjoso en la negativa hemos visto hasta el momento que la concentración más estable corresponde entre un 25% a 28% de ácido sulfúrico por proporción de agua destilada Por otro lado, si tenemos conocimientos un poco más avanzados podemos considerar también usar una base que de un precipitado insoluble para facilitar su separación, en estos casos tendríamos la cal apagada Ca(OH)2 o el Sulfato de Calcio, que es poco toxico e insoluble. Debemos ser conscientes que la neutralización es exotérmica, y se debe realizarla de forma muy lenta, con un buen agitado e incluso agregando agua para evitar altas temperaturas y diluir el ácido puede ayudar. Como todo el residuo que obtenemos tiene impurezas de metales pesados debemos asegurarnos que se le trata de acuerdo a las regulaciones ambientales para evitar intoxicarnos y la contaminación, aunque todo esto ya escaparía del propósito de estos reportajes. Por hoy nos detendremos aquí, para no extendernos hasta el infinito. En el siguiente reportaje (tranquilos que será solo en unas semanas) si todavía no estáis desalentados tras comprender la dificultad, .ya nos meteremos de una manera “práctica” con los experimentos que hemos realizado. Porque la eficiencia, capacidad de acumulación y duración de un acumulador reciclado, incluso añadiendo productos químicos externos que alarguen su duración y capacidad como se hace en los procesos industriales, no alcanzará nunca el inicial, ni en un 80%. Solo podemos como ya hemos explicado reproducir un modelo básico regenerando los componentes de la batería y transformándola en una batería de “principios de siglo”, la calidad de la aleación de nuestra batería es importante, pero hay un problema: esta aleación se diseña para convivir con tratamientos externos de las capas de plomo y el electrolito, así que a veces su complejidad de diseño empeora el problema si la simplificamos al restaurarla y otras veces la mejora, no lo podemos saber. Solo hay algo más claro, normalmente las baterías más baratas y de peor calidad tienden a ser más fáciles de reciclar, porque usan diseños más simplificados sin tanta complejidad en aleaciones, empastado y electrolito. Por tanto al reducirlas a un modelo de diseño básico las posibilidades de reacciones químicas inesperadas se reducen. En unas semanas publicaré la siguiente parte de este reportaje, si no estáis ya desanimados y este os ha resultado interesante, os adelanto que comenzaremos por algo que no pensasteis que haría falta para estos menesteres y que resulta esencial: una “grua-soporte” de poleas o algo parecido que os ayude a manipular con facilidad los acumuladores. Como siempre contestaré a todas vuestras preguntas según tenga tiempo, suelo tardar a veces, pero os garantizo que nunca dejo a nadie esperando una respuesta, sea la que sea. Recuerda que estos reportajes para que sean buenos, requieren muchas horas de trabajo y estudio, no ponemos publicidad ni te pedimos nada, así que te agradeceríamos un "like" o que los distribuyas por tus grupos y redes sociales para que tengan visitas y los puedan ver gente interesada, así sabremos que vale la pena seguir haciendo trabajos tan específicos. Y otras dos cosas muy importantes para terminar por hoy: Que os aseguréis de comprobar toda la legislación vigente en vuestro lugar de residencia, pues varía mucho respecto a la autorización para manipular materiales tóxicos, como es el caso de baterías y el volumen autorizado. Tomar todas las medidas de seguridad necesarias, sin escatimar. Los materiales contenidos en una batería, son muy tóxicos en cantidades muy pequeñas y pueden provocaros graves daños acumulativos o inmediatamente tanto por inhalación, ingestión o contacto. Sed prudentes, responsables y respetar el medio ambiente. Raul Mora M. Temas relacionados: Curso de electrónica, Electrónica, Raul Mora M. Reconocimientos y más información sobre la obra gráfica ADVERTENCIA: En este foro, no se admitirán por ninguna razón el lenguaje soez y las descalificaciones de ningún tipo. Se valorará ante todo la buena educación y el rigor sobre el tema a tratar, así que nos enorgullece reconocer que rechazaremos cualquier comentario fuera de lugar.
46 Comentarios
Felix Real
31/3/2019 14:59:03
Por fin han publicado la segunda parte, pensé que al final nunca lo harían, muchas gracias. Soy profesor de primaria (hablamos de niños de 12 años) y siempre me ha costado mucho intentar explicar de forma amena en clases de prácticas y que sea segura como funciona una batería y los peligros medioambientales, así que sus trabajos me resultan muy útiles para mis resúmenes. Después de leerlo detenidamente tengo una duda: si quisiera yo entonces construir una batería de plomo desde 0 según como se hacían a principios de siglo, ¿solo tendría que usar dos placas de plomo sin más añadidos ?¿separadas por un aislante en el mismo bote? luego poner ácido con agua destilada y realizar la carga ¿Sería ácido a 1.08g/ml? ¿Qué voltaje inicial debería obtener? con 100 cm2 por placa podría llegar a obtener suficiente corriente para encender una bombilla LED de 12V - 5W (0.5A aproximadamente) Anteriormente lo he intentado pero nunca alcanzaron densidades de corriente relevantes con dos placas de esa superficie y separadas por fibra de vidrio pura. En la carga rápidamente comenzaban a burbujear por la expulsión de oxigeno e hidrógeno. ¿Podrías decirme que hago mal? Aunque fuese por privado. He creído entender que tienes un grupo de trabajo para experiencias, ¿Podría contactar? Muchísimas Gracias Raúl.
Responder
Baterías 2da parte – Anexo preguntas
Responder
Máximo Gila
2/4/2019 01:46:07
Hace 6 meses cambié los aislantes de un acumulador Exide 2V-800 con unos 12 años por otros de polipropileno en forma de micro malla, porque se destrozaron al quitarlos, limpié las placas de plomo con mucho cuidado, tardé 5 días enteros en terminar y una semana más en alcanzar una carga aceptable pero el plomo esponjoso generado ha acabado por desprenderse poco a poco, no creo que el proceso valga la pena, apenas creo que alcance el 65-70% de su carga efectiva y resulta ya muy problemática de recargar dentro del grupo, sólo han pasado 6 meses y las placas no creo que se puedan volver a limpiar sin dañarlas. Si hubiese más separación entre placas sería más sencillo, pero lo veo un trabajo imposible de hacer correctamente para que queden reutilizables y ya me gasté 100 euros intentando reparar este. Por favor Raúl, explica el mejor método para limpiar las rejillas, porque el que me explicaron está claro que no funciona o hice algo mal. Felicidades por tus post, intenta prodigarte más por favor.
Responder
Hola Máximo, como le he dicho a Félix, disculpa el retraso, pero ya estoy aquí.
Responder
Riso Garcés
9/5/2019 12:36:30
Felicidades Raul por sus post, maravillosos. Da gusto el tiempo que se toma en contestar. Una pregunta solamente ¿Cuál seria el grosor mínimo de una placa de plomo para construir un acumulador? ¿Y el rendimiento frente a la misma superficie de una placa del mismo tamaño en una batería o acumulador solar?. Un saludo desde Argentina
Responder
Hola Riso, supongo que el límite inferior queda definido por las capacidades propias a la hora de la construcción (fundición). A menor grosor, menor probabilidad de recuperación: Personalmente y por documentación el límite inferior para experimentación estaría en los 1,5mm y el superior en torno a los 3mm.(yo trabajo con placas de 2 o 2,5mm que ya son bastante pesadas). El grosor no afecta apenas a la capacidad de acumulación o el rendimiento, pero si a la probabilidad de recuperación y una manipulación fiable. Una vez más (y perdón por la insistencia machacona) si vas a trabajar con plomo y los componentes de una bateria (en este caso fundición) recordar el peligro de los gases y la toxicidad si no se utilizan las medidas adecuadas. Suerte Riso!
Responder
juan gallino
1/6/2019 02:14:14
hola raùl t felicito por el post mi pregunta es que estoy por intentar armar un baso d un sistema solar q tengo que fallo y lo pensaba armar de cero es decir tengo muchas baterias en desuso desarmarlas fundir el plomo hacer placas nuevas en el sistema plantè pero no me queda claro si las conecto al cargador las descargo varias veces o las debo invertir la polaridad para formarlas es decir el positivo conectarlas al negativo y luego nuevamente al positivo y asi sucesivamente desde ya agradezco tu respuestas saludos desde uruguay
Responder
Hola Juan,
Responder
Manolo Martí
27/6/2019 21:03:53
Es que..., cuesta mucho más leer para conocer y aprender que ver un simple video placebo en YouTube.
Responder
Hola Manolo,
Responder
Jacinto Perez
22/7/2019 04:31:16
Hola Raúl. Solo escribo para agradecerte y reconocer el tiempo, más bien tu tiempo, que nos regalas en este y el anterior reportaje. ¡Muchas Gracias!
Responder
Sabiel Romero
14/6/2020 20:33:58
Me sumo,
Responder
Alfonzo Suarez
24/9/2019 03:55:36
Saludos Raul
Responder
Hola Alfonzo!
Responder
Raúl Mora
29/9/2019 13:47:37
Continuo aquí la respuesta Alfonzo ....donde el tiempo de producción cuenta, la solución más sencilla creo que estaría en negociar con una empresa del sector químico/metalúrgico un buen precio y una negociación para el procesado de las baterías recogidas (ya se que es algo complicado) de todas maneras procuraré explicar el proceso “externo” de empastado de placas de plomo y la calidad que deben tener por si buscas realizar tu mismo el proceso (yo creo que es posible alcanzar una técnica rentable, pero te harán falta conocimientos, dedicación, instalaciones y cierta inversión económica, ya he explicado algo sobre el proceso industrial de empastado/curado). Así que intentaré comentarlo en profundidad (eso es un trabajo complejo de redactar para el lector neófito en química y metalurgia pero estoy hace unos meses con ello). Así que atento!
Responder
RICARDO RUBIO
25/11/2019 20:02:46
RAUL BONITO DIA Y GRACIAS POR TAN IMPOTANTES DATOS CON BASES PRECISAS MUCHAS FELICIDADES SALUDOS.
Responder
Luis Barboza
26/2/2020 15:49:43
aca en uruguay conozco dos talleres de reciclado y restauración de baterías. quedan muy bien. pero no destruimos el contenedor como quien troza un pollo!!! se hace una estría sin llegar a al interior y se usa calor y/o solvente según la bateria. de esta forma se desarma sin hacerla mierda, se limpia, cambia lo necesario; se calibra y se vuelve a cerrar. al el electrolito se le evapora el agua y se procesan los sólidos. No tiene mucha magia mas que evitar que la agarre Conan el Bárbaro!!
Responder
hola Luis, con las medidas de seguridad de la normativa europea ES IMPOSIBLE abrir una batería sin destrozar el contenedor de ABS, si en Uruguay se autorizan las baterías sin sellado irreversible, pues vale ( más abajo verás un video de Rey en la India donde también te abren una bateria con un cortafrios, pero en España por ejemplo no vas a encontrar baterías de coche tan sencillas se abrir (módulos de almacenamiento si) . Luego por mucho que la abras, si las rejillas están destruidas, si no vuelves a empastar (y dispones del material adecuado y la seguridad) pues como no hagas magia.... por cierto, me has alegrado el día comparándome con Conan. Un abrazo
Responder
Roger
27/5/2020 08:09:57
Hola mucho gusto soy roger de panama y me encantaría si se puede aprender con usted a recuperar baterías de acido ya que en mi país no existe esto me encantaria conversar con usted y si es posible a futuro me diera un tutoreal por favor me podria escribir [email protected] saludos
Responder
Hola Roger! Me temo que no puedo ayudarte personalmente, no es tan sencillo! NUNCA aconsejo reparar baterías si no dispones del equipo, recursos, preparación y medidas de de seguridad, precisamente escribo para informar de los problemas concretos y buscar soluciones concretas, pero todavía no he llegado al grado de poder aconsejar a ese nivel, lo siento. Se prudente! es algo muy peligroso ! Ah y no existe en ningún lado un tutorial "milagroso" para resucitar todo tipo de baterias (o algún tipo) se prudente con lo que consigas!
Responder
Sabiel Romero
14/6/2020 20:30:38
Hola!!!
Responder
Muchísimas Gracias"! Esto anima el espíritu! Tranquilo! habrán más partes pero con el COVID hacer un trabajo de esta escala es complicado, ya que no es ponerse delante del ordenador y ya está, además he tenido "bastante" (entre comillas, jajaja) éxito con estos artículos, lo que me ha llevado a tener que contestar nuevas cuestiones, problemas y poder abarcar soluciones con rigor. Un abrazo Sabiel
Responder
Jónathan
8/7/2020 23:27:11
También me he quedado en shock :v después de leer toda esta información
Responder
Hola Jonathan, disculpa la tardanza en comentar. (Dichoso COVID!) bueno, me temo que a estas alturas ya tendrás la respuesta; si le puso agua destilada y no ajusto el nivel de ph en cada vaso, pues posiblemente poco daño, (dices que el ácido estaba muy bajo, no? si fue poco tiempo, no es grave hasta cierto punto) si rebaso los niveles hasta llenarla y que saltara el líquido de vaso en vaso alegremente eso es malo!!!! y si en vez de agua le metio una mezcla de ácido sulfúrico sin comprobar nada, posiblemente tu batería ya esté muerta R.I.P. me equivoco? Un abrazo Jónathan y mucha suerte !
Responder
Mario
7/8/2020 20:05:43
He leîdo a grandes rasgos la 1ra y 2da parte y los encontré muy interensante para obtener una copia en pdf de estos articiculos en relacion a la baterias que debo hacer?
Responder
Si te quieres hacer una copia personal para leerlo en cualquier parte, te la puedes hacer simplemente diciéndoselo al navegador! En casi todos( Firefox, Chrome...) puedes decirle que te lo guarde o imprima en formato .pdf. En NeCLO no ponemos "trampas" para que las copias salgan "ilegibles" . Buscamos extender el conocimiento.! Simplemente vete por ejemplo a Chrome y dile "imprimir" y luego en " guardar en pdf". Más fácil imposible
Responder
Rey
21/10/2020 01:49:50
Buenas tardes, quisiera saber que opina sobre estos vídeos,donde enseñan la restauración de baterías, desde como se abren, el fabricado de las placas y su respectivo empastado, la conexión de estas, el sellado de las baterías, el relleno con ácido y la carga. Coincido con usted en cuanto a la fabricación de estos productos de modo que sean obsoletos y a la grave contaminación del medio ambiente, junto con el peligro irreversible que provoca para la vida, ya que, sí los fabricantes quisieran podrían hacer los productos de mejor calidad e incluso que puedan ser reparables, claro que tal vez no sea muy buen negocio para ellos a menos que aumenten precios, pero a la larga es mejor así para todos, ya que se crea demasiada contaminación, incluso hasta en el reciclado y no es sostenible para la vida en la tierra, el plomo es veneno para la vida y no digamos del sulfato que tienen las placas, que por cierto acabo de manipular y que gracias a usted me acabo de enterar del peligro de estas. Con respecto a los videos de los que hago referencia están aquí: "https://www.youtube.com/watch?v=VEvPjOKkPyE&list=LL&index=1&t=25s" y "https://www.youtube.com/watch?v=afwO_MZjRjA&list=LL&index=24" A mi parecer con las medidas de seguridad adecuadas se podrían reparar las baterías muy bien e incluso diseñar una y hacer algún prototipo de muy buena calidad, que sea reparable y aun asi hacer un buen negocio, ante todo debe estar la calidad y el bienestar del medio ambiente ya que por ahorrarse unos pesos y crear mas ganancias hemos creado problemas de costo incalculable para toda la vida en el planeta. Espero pueda ver los vídeos, sé que es lamentable el como las personas se exponen a realizar estos trabajos sin las precauciones necesarias y como se contamina el lugar donde trabajan exponiendo su salud y la vida, pero me encanta su ingenio y como se las arreglaron para reparar las baterías, hasta ahora de los mejores vídeos que he encontrado en cuanto a la reparacion de baterias.
Responder
Hola Rey! Muchas gracias por los videos!
Responder
El sistema de sellado asusta! El más mínimo impacto y la tapa saldría volando dejando que el electrólito se derramara!!!! En caso de accidente, junta gasolina con ácido sulfúrico y solo te puedo decir una palabra peor: Napalm!!!!
Responder
ighory
31/10/2020 21:39:45
buenas tardes, me ha encantado este reportaje , y estoy contigo que los indúes,y pakitanís es una autentica locuras , entre 7 y 15 años para llegar a ese punto de locura agresiva que ese el saturnismo .pero que el ácido sulfúrico lo reutilicen y al desagüé o a tierra el resto tampoco es que de mucha seguridad a los vecinos del taller ni a los viandantes .
Hola Ighory! (Vaya, este alias no lo conocía!) pues si una locura tota.!!!...lo que mas miedo me dio fuever como respiraban gases de plomo de la fundición y tocaban alegremente el interior de la batería (si aguantan 7 años sin una enfermedad neurológica gravísima ya
Responder
ighory
18/11/2020 21:51:27
Gracias Raúl por contestar , o que me creas la duda es que si sumerges 2 trozos de plomo de mismo origen en el ácido y le aplica respectivas cargas opuesta , no se crea suficiente plomo poroso ?.aunque tras un tiempo se tenga que volver a ajustar la mezcla ácida.
Responder
Jose Francisco Docavo Alberti
4/1/2021 20:37:09
Hola Raúl
Responder
Jorge L Hernández Suárez.
6/1/2021 14:29:51
Feliz y bendecido día!.
Responder
Estimado Jorge, GRACIAS por tu excelente artículo y también por desmontar por fin tanto bulo sobre la regeneración de baterías, de todos esos vendedores de elixires maravillosos y bálsamo de Fierabrás.
Responder
Adriano
8/2/2021 22:20:26
Muy buena la información
Responder
ramon silva
25/7/2021 04:35:14
Simplemente !!!GRACIAS!!!
Responder
LUIS HERRERA
17/8/2021 21:29:38
Cordial saludo .
Responder
Cesar
27/12/2021 16:39:54
Yo repare mi bateria después de 4 años de uso y ya tiene 2 más funcionando así...
Responder
Japon
16/6/2022 03:41:44
disculpa, dices cubrir las placas alrededor de 1cm-1,5cm. Sobre el nivel de la placa o solo echar 1cm de mezcla?
Responder
Pedro Cruz
7/4/2022 04:23:18
Buenas noches, es conveniente agregar agua destilada como una alternativa para mejorar la carga de la batería?
Responder
Jose
18/9/2022 19:35:50
Excelente explicación de la primera y segunda parte, el tema bastante amena e interesante, ojalá publiques pronto la tercera parte, saludos
Responder
Jose Luis
18/12/2022 13:51:12
Muy buen artículo, casi todos deseamos que las baterias sean lo mas eternas posibles ,deberian fabricarlas con los vasos desmontables, se estropea un vaso, lo cambias y no tiras la bateria entera, por economia y ecologismo.
Responder
Deja una respuesta. |