MEDICINA |
|
|
Pastillitas de ciencia. Hoy: Alzhéimer
NIH
Con el comienzo del año vamos a repasar los avances en la investigación del Alzhéimer con los últimos hallazgos y perspectivas, como el posible origen en el hígado, la posibilidad de transmisión o el papel del virus del herpes.
Un año pasado de ideas claras y avances
Cuando hablamos de Alzhéimer actualmente ya todos somos conscientes de que no se trata tan solo de perder la memoria, esta enfermedad neurodegenerativa, causada por la destrucción progresiva de las neuronas cerebrales, afecta a un conjunto de capacidades esenciales para la vida diaria y la independencia, cuyo deterioro no se puede revertir y que con el crecimiento del promedio de esperanza de vida en el mundo, hace de este, un problema más grande y evidente, que se ha transformado en una de las grandes batallas de la investigación. A comienzos del pasado año el nuevo escenario de investigación estaba claro, los neurólogos expertos coincidían que el gran problema comienza hasta dos décadas antes de que aparezcan los síntomas, generalmente, al alcanzar los 60 años. Existen muy pocos fármacos que puedan ralentizar el progreso de la pérdida de memoria que acompaña al Alzheimer, pero lo más preocupante es que cuando la enfermedad se diagnostica, ya es demasiado tarde y se ha producido un daño irreversible en el cerebro, cuyo deterioro lleva a la muerte inexorablemente . Así, parece ser que por eso, la mayoría de los ensayos con medicamentos para el Alzheimer han fracasado en parte, ya que no se investigó y se tuvo en cuenta personas con las primeras etapas de la enfermedad muchos años antes. Pero por suerte, ahora la comunidad médica y científica es consciente de estos errores para abordar el problema y poco a poco las nuevas estrategias van dando resultados, a principios del anterior ciclo, este cambio se remarcaba con el estudio publicado en la revista Nature, donde se destacaba la investigación de un grupo de médicos japoneses y australianos que identificaron mediante un análisis de sangre, ciertos fragmentos de proteínas amiloides y nudos de tau, que son las que se acumulan en el cerebro, lo degrada y causan esta terrible enfermedad. La necesidad de identificar la enfermedad a tiempo o las causas y factores que la desencadenan años antes de que visibilice se ha transformado en una prioridad para poder afrontarla con probabilidades de éxito y con estos objetivos en mente este biomarcador sanguíneo fue descubierto por investigadores del Centro Nacional de Geriatría y Gerontología de Japón, en un estudio que involucró a 400 voluntarios, con personas que eran cognitivamente normales, tenían un deterioro cognitivo leve o tenían un diagnóstico de enfermedad de Alzheimer.
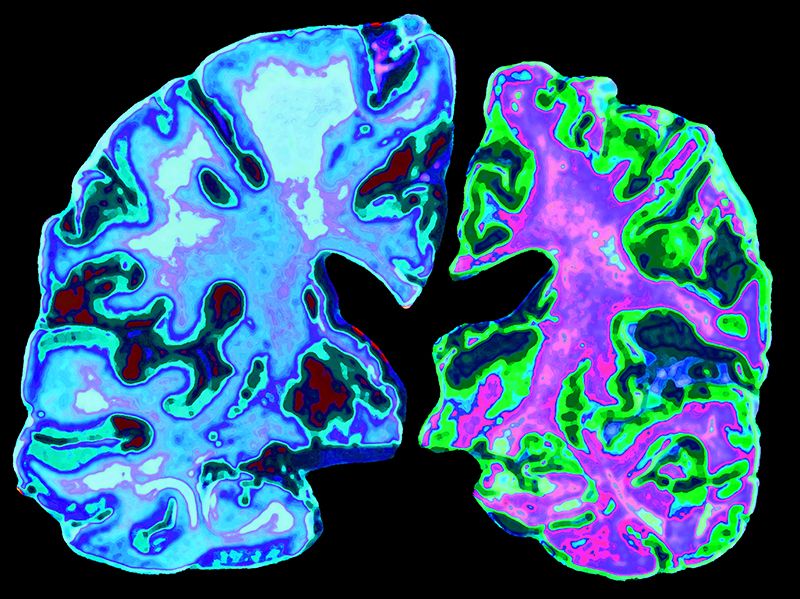
En la izquierda de la imagen podemos ver un cerebro normal perteneciente a una persona de 70 años, frente al cerebro de una persona de 70 años con enfermedad de Alzheimer a la derecha. Créditos: Jessica Wilson / Science Photo Library
Aún hay un largo camino por recorrer antes de que este tipo de prueba se pueda utilizar en un entorno clínico, pero investigadores de la Universidad de Washington en Saint Louis ya están desarrollando métodos para diagnosticar la enfermedad utilizando fragmentos de proteína amiloide y biomarcadores tau. Lo esperanzador de este hallazgo es que una simple prueba de sangre que se le podría hacer a cualquier persona y a cualquier edad podría combatir el Alzheimer en sus primeras etapas, incluso si estas proteínas no resultan ser lo suficientemente buenas para usarlas como una prueba definitiva para el Alzheimer, los resultados podrían ayudar a los médicos a saber qué pacientes deberían someterse a un examen de PET o una punción lumbar para confirmar el diagnóstico de Alzheimer. ¿Por qué algunos cerebros resisten a la enfermedad? A mediados de año parece que comenzamos a tener respuesta para una pregunta de hacía tiempo: se sabe que algunas personas pueden esquivar la enfermedad de Alzheimer a pesar de que su cerebro mostraba todos los signos que se consideran característicos de esta patología neurodegenerativa. Lo que no se sabía hasta ahora es cómo lo lograban, como ya sabemos, los pacientes con Alzheimer acumulan en sus cerebros dos tipos de proteínas anómalas que deterioran las comunicaciones entre las neuronas: las proteínas beta amiloideas, que forman placas amiloides, y las proteínas tau, que forman “marañas enredadas”. Pero algunas personas parecen inmunes a esas proteínas tóxicas pese a tenerlas en su cerebro. Así que saber el porqué podría conducir a abordajes alternativos a los actuales. En esta dirección precisamente la Universidad de Texas publicaba en el Journal of Alzheimer’s Disease anunciaba que había encontrado una importante pista para explicar qué hay de especial en el cerebro de los “afortunados” cerebros resistentes al Alzheimer. Giulio Taglialatela, director del Centro Mitchell para Enfermedades Neurodegenerativas, explicaba como en estudios previos, se descubrió que en las personas que no llegaban a desarrollar demencia, las proteínas tóxicas beta amiloide y tau no se acumulaban en las sinapsis, el punto de comunicación entre las neuronas. Cuando las neuronas no pueden comunicarse debido a la acumulación de estas proteínas tóxicas, el pensamiento y la memoria se deterioran, así que había que averiguar qué hacía que las sinapsis de estas personas fuera capaz de evitar la acumulación de las proteínas tóxicas beta amiloide y tau. Para ello, los investigadores utilizaron electroforesis y espectrometría de masas para analizar la composición proteica de las sinapsis aisladas de tejido cerebral congelado de personas que habían participado en largos estudios de envejecimiento cerebral y a los que se hicieron evaluaciones neurológicas y neuropsicológicas durante su vida. Los resultados mostraron que los participantes resistentes tenían una composición de proteínas especial en las sinapsis que los diferenciaba tanto de los pacientes con enfermedad de Alzheimer como de los participantes sanos y que podría ser el motivo por el que en sus sinapsis no se acumulan las proteínas toxicas, explicando por qué sus cerebros resisten al Alzheimer a pesar de que sus pruebas cerebrales apuntaban a todo lo contrario. Todavía no se comprende los mecanismos exactos responsables de esta protección, pero descifrarlos podría poner sobre la pistas de nuevas dianas terapéuticas.
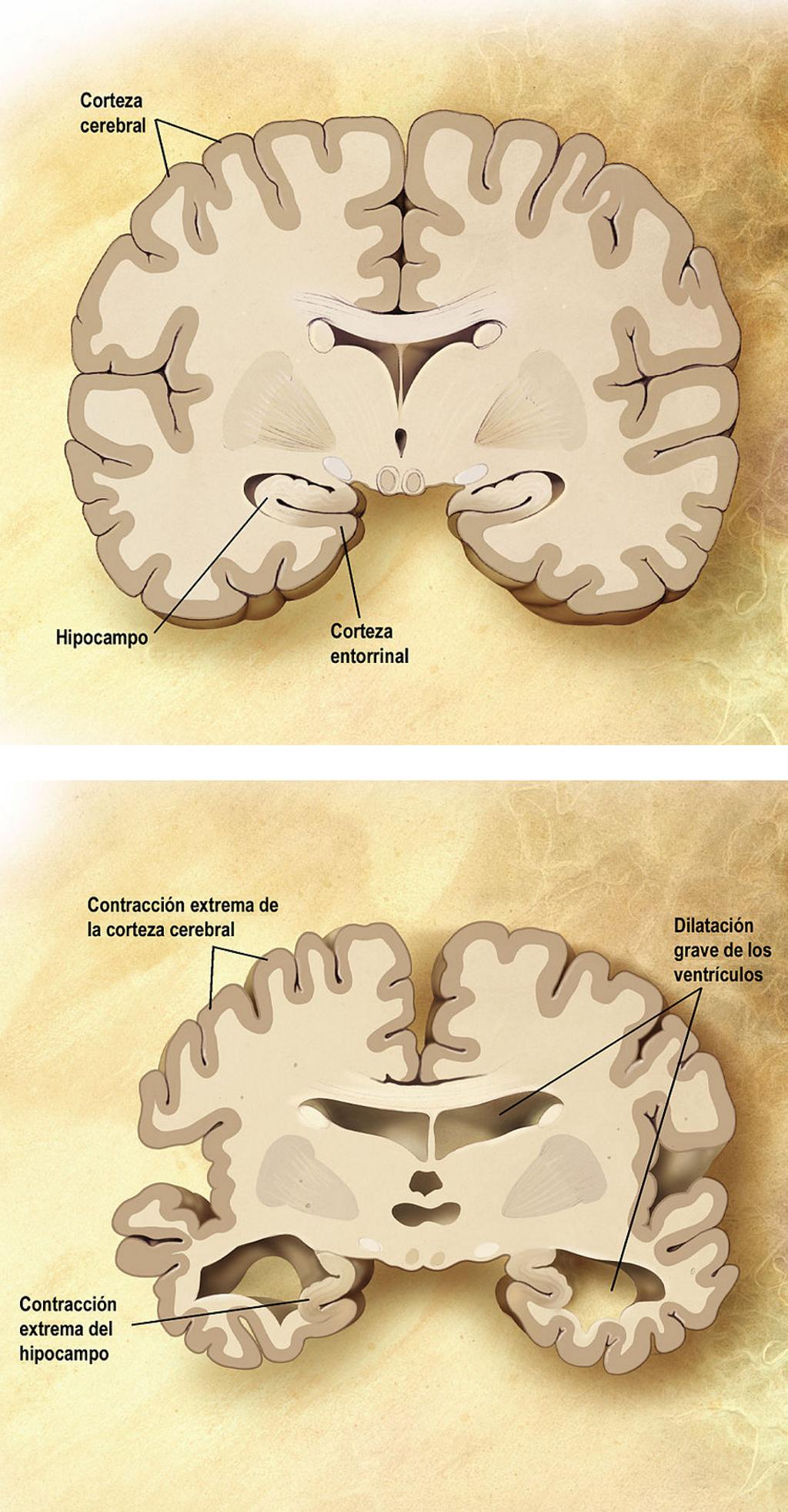
Esquema de un corte frontal de dos cerebros. El de la izquierda es un cerebro sano y el de la derecha uno que padece la enfermedad de Alzheimer. En la imagen se describen las diferentes consecuencias morfológicas tras un periodo dilatado de exposición a esta enfermedad. David Perez
Nuevas estrategias de combate Con el paso del año hemos ido conociendo nuevas estrategias para combatir las partículas tóxicas que destruyen las células cerebrales y destacaremos esta vez al equipo de la Universidad de Cambridge (el Reino Unido) liderado por los investigadores Michele Vendruscolo, David Reynolds y Sir Christopher Dobson, con su trabajo publicado en la revista especializada PNAS a mediados de año. Era la primera vez que se proponía un método sistemático para atacar a los patógenos, causantes de la enfermedad y que han sido identificados recientemente, como pequeños grupos de proteínas conocidas como oligómeros. La técnica se basa en un nuevo enfoque de cinética química desarrollado en los últimos diez años, que ayuda a descubrir fármacos contra las enfermedades de plegamiento de proteínas, como es el caso del Alzheimer. Estas proteínas que normalmente son responsables de los procesos celulares importantes, cuando las personas padecen la enfermedad de Alzheimer alteran sus funciones, formando “grupos” y dañando a las células nerviosas sanas. Estas proteínas mal plegadas forman grupos anormales llamados placas que se acumulan entre las células nerviosas, impidiéndoles señalizar adecuadamente. Normalmente, las proteínas necesitan plegarse en una estructura específica para funcionar correctamente y cuando este proceso falla, se pueden formar depósitos peligrosos, que pueden causar la demencia. Al perder el cerebro la capacidad para deshacerse de estos depósitos peligrosos al envejecer, provoca enfermedades de demencia. Así que era esencial mejorar el enfoque para mejorar el progreso del descubrimiento de fármacos y acelerar los nuevos tratamientos para los enfermos de Alzheimer y no solo encontrando compuestos que se dirijan a los oligómeros tóxicos que dan lugar a trastornos neurodegenerativos, sino también aumentando su potencia de una manera racional. ¿El Alzheimer es “transmisible”? Otra de las preguntas sobre esta enfermedad ha encontrado a finales de año un fuerte “empuje” hacía una respuesta definitiva tras el artículo publicado en Nature por John Collinge, un neurólogo del University College London que dirigió la investigación: "Transmissible’ Alzheimer’s theory gains traction” donde pruebas con ratones confirmaban que las “proteínas viscosas” asociadas con enfermedades cerebrales degenerativas pueden transmitirse entre personas, aunque probablemente los riesgos para los humanos son mínimos.
En el año 2015, sucedió un descubrimiento muy significativo en la investigación del Alzheimer, tras analizar más de 3.600 cerebros postmortem, los investigadores de la Clínica Mayo, llegaron a la conclusión de que muy probablemente estábamos equivocados, pues la verdadera proteína disfuncional que impulsaría la enfermedad de Alzheimer sería la proteína tau, igualmente, la proteína beta-amiloide también contribuye a la enfermedad y es característica, se acumula y aparece durante la progresión de la demencia, e incluso sirve como marcador de dicha progresión, pero ya no era la causante principal como se creía.
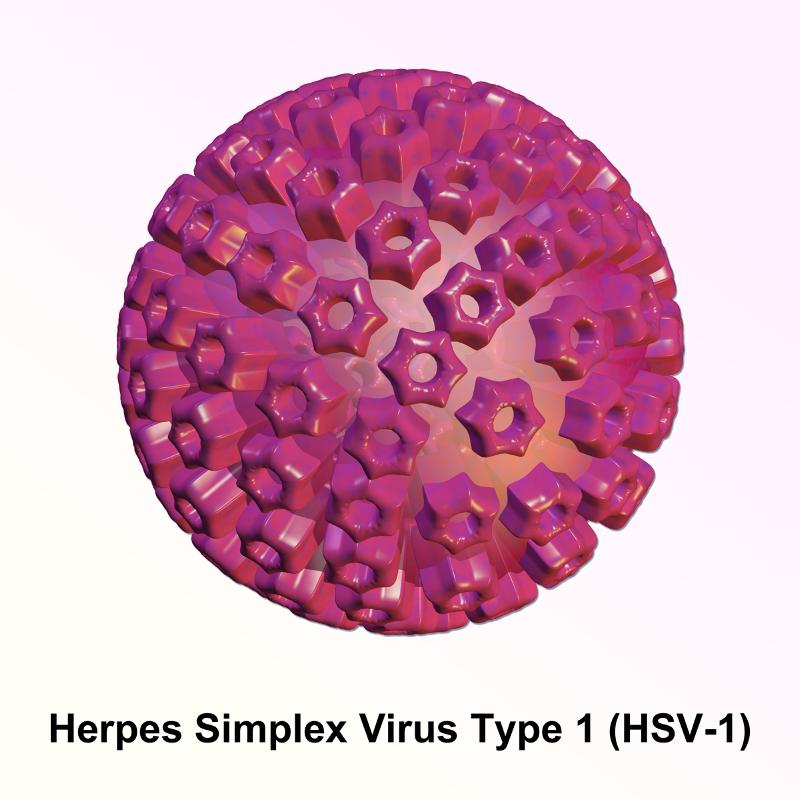
Los investigadores han acumulado más evidencias acerca de que las proteínas viscosas, una característica de las enfermedades neurodegenerativas, pueden transferirse entre personas bajo condiciones particulares y causar un nuevo daño en el cerebro del receptor. Su investigación no sugiere que trastornos como la enfermedad de Alzheimer sean contagiosos, aunque ciertos procedimientos médicos y quirúrgicos podrían suponer un riesgo de transmisión de tales proteínas entre los seres humanos, lo que más tarde podría conducir a enfermedades cerebrales. Hasta este punto todo resulta “normal”, pero el trabajo continúa con un polémico estudio donde los investigadores descubrieron depósitos extensos de proteína beta-amiloide durante los exámenes post mortem de los cerebros de cuatro personas en el Reino Unido que habían sido tratados por baja estatura durante la infancia con preparaciones de hormona de crecimiento derivadas de las glándulas pituitarias de miles de donantes después de la muerte. Los pacientes tratados habían muerto tras padecer una enfermedad neurodegenerativa rara llamada enfermedad de Creutzfeldt-Jakob (ECJ), causada por la presencia en algunas de las preparaciones de la hormona del crecimiento de una proteína o prión infecciosa y mal plegada que causa la ECJ. Los patólogos no esperaban ver la acumulación de amiloide a una edad tan temprana y sus colegas sugirieron que pequeñas cantidades de beta-amiloide también se habían podido transferir de las muestras de la hormona del crecimiento, causando las placas amiloides características. Las conocidas placas de amiloide en los vasos sanguíneos del cerebro son el sello de una enfermedad llamada angiopatía amiloide cerebral (CAA) y causan sangrado local. Pero en la enfermedad de Alzheimer, las placas amiloides suelen ir acompañadas de la proteína tau, aunque este no fue el caso en los cerebros de los cuatro pacientes afectados de CJD, que en cambio tenían las características distintivas de la CAA. El equipo de Collinge pudo localizar los lotes antiguos de la preparación de la hormona del crecimiento almacenada como polvo durante décadas (ahora se emplea un variante sintética) en los laboratorios de Porton Down, un centro nacional de investigación de salud pública en el sur de Inglaterra. Así que analizaron las muestras y confirmaron sus sospechas al descubrir que algunos de los lotes contenían niveles sustanciales de beta-amiloide y proteínas tau, a continuación inyectaron muestras directamente en el cerebro de ratones jóvenes modificados genéticamente para que fueran susceptibles a la patología amiloide. ¿Consecuencia? A mediados de la vida, los ratones habían desarrollado extensas placas amiloides y CAA, así que ahora están comprobando en experimentos con ratones separados si lo mismo ocurre para la proteína tau. Parece pues que la transmisibilidad de la beta-amiloide podría preservarse después de tantas décadas ya que el amiloide viscoso se adhiere fuertemente a los materiales utilizados en los instrumentos quirúrgicos, resistiendo los métodos de descontaminación estándar, pero dado que las enfermedades degenerativas tardan mucho tiempo en desarrollarse, el peligro de cualquier transferencia puede ser más relevante en el caso de la cirugía infantil, donde también se han utilizado instrumentos en personas mayores. Hasta ahora, los epidemiólogos no han podido evaluar si un historial de cirugía aumenta el riesgo de desarrollar una enfermedad neurodegenerativa en el futuro, porque las bases de datos médicas tienden a no incluir este tipo de datos, aunque está claro que a partir de ahora cobrará importancia. Herpes y Alzheimer Continuando esta primera parte sobre lo que nos ha traído la investigación este último año, no podemos seguir sin mencionar el tipo 1 del virus del herpes simple (HSV1), virus también implicado en la enfermedad de Alzheimer, aunque más conocido comúnmente por causar herpes labiales.
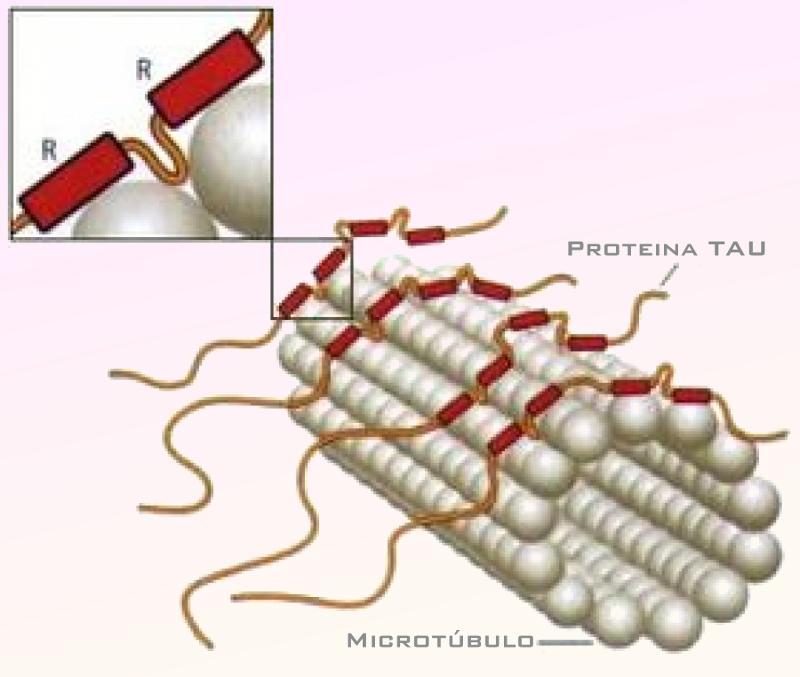
Bruce Blaus
Suele afectar a la mayoría de la gente en la infancia y después queda latente en el sistema nervioso periférico, es decir en las zonas del sistema nervioso que no es el cerebro ni la espina dorsal. Pasada la infancia, a veces, cuando estamos expuestos a situaciones de estrés, el citado virus se activa provocando la aparición de herpes labiales. Pero a principios de la última década del siglo pasado comenzaron las pistas cuando se descubrió que en muchas personas mayores el HSV1 se hallaba también presente en el cerebro. Solo 6 años mas tarde en 1997 ya se pudo relacionar que si el HSV1se encontraba en el cerebro de personas que tenían un gen específico conocido como APOE4, existía un elevado riesgo de desarrollar Alzheimer, siendo posible que este virus pudiera activarse en el cerebro de forma reiterada, lo que probablemente cause daños acumulativos. Así pues la probabilidad de desarrollar la enfermedad es 12 veces mayor en personas portadoras del APOE4 que tengan el HSV1 en el cerebro que en quienes no aparecen estas dos peculariedades. Tanto los propios investigadores en 2007 como otros, incluido el Instituto de Microbiología de Facultad de Ciencias de Universidad Austral de Chile en 2008 y el Departamento de Biología Molecular y el Centro de Biología Molecular “Severo Ochoa” de CSIC-UAM en 2012–, decubrieron que la infección de cultivos celulares con el HSV1 provoca acumulación de beta-amiloide y proteínas tau anormales, característica como ya hemos comentado de la enfermedad de Alzheimer. Por tanto los investigadores creen ya firmemente que el HSV1 es uno de los principales factores que contribuyen al desarrollo de esta enfermedad y que se introduce en el cerebro de las personas mayores a medida que su sistema inmunológico va debilitándose con la edad. Llegado ese punto crea una infección que queda aletargada, pero que puede reactivarse debido a situaciones de estrés, a un sistema inmunológico debilitado o a inflamación cerebral causada por la infección de otros microbios. Esta reactivación produce daños víricos directos en las células infectadas, así como inflamaciones también víricas, sospechando los investigadores que una activación repetida del virus provoca daños acumulativos que, al final, acaban conduciendo a la enfermedad de Alzheimer en personas con el gen APOE4, debido a la mayor formación de productos tóxicos por parte del HSV1 o a una menor reparación de los daños. Por tanto, consideran que podrían utilizarse agentes antivirales para tratar la enfermedad de Alzheimer, impidiendo la formación de nuevos virus y de este modo, limitar los daños víricos. Ya se han realizado estudios anteriores por ejemplo con el aciclovir, reafirmando que existe una relación entre el virus del herpes y la enfermedad de Alzheimer, pero no que dicha relación sea causal. Pero el éxito reciente —demostrado por un estudio de población a gran escala realizado en Taiwán— del uso de determinados agentes antiherpéticos concretos para prevenir la enfermedad de Alzheimer resulta esperanzador.
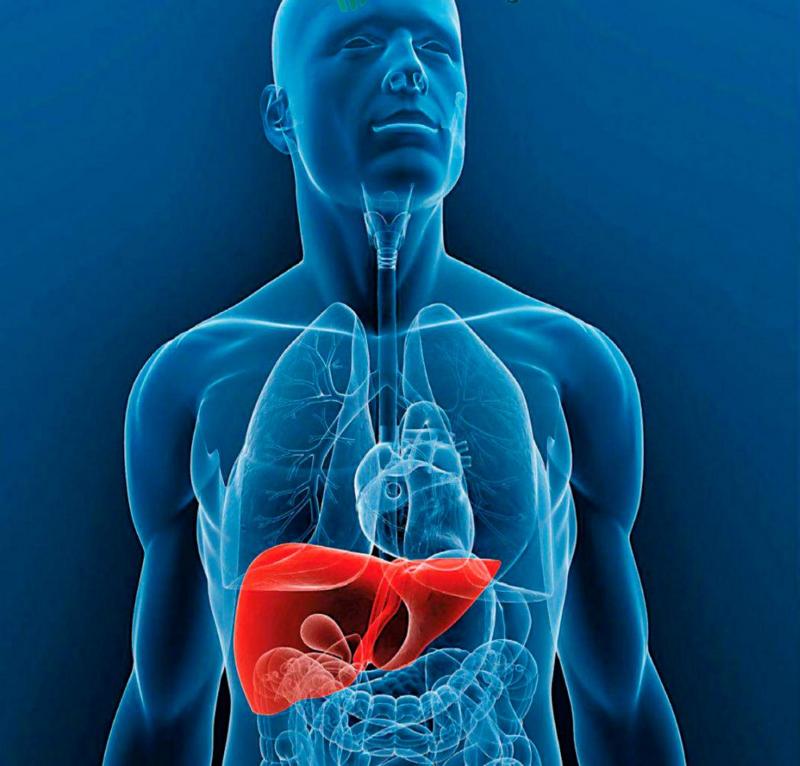
¿Y si el origen estuviera en el hígado?
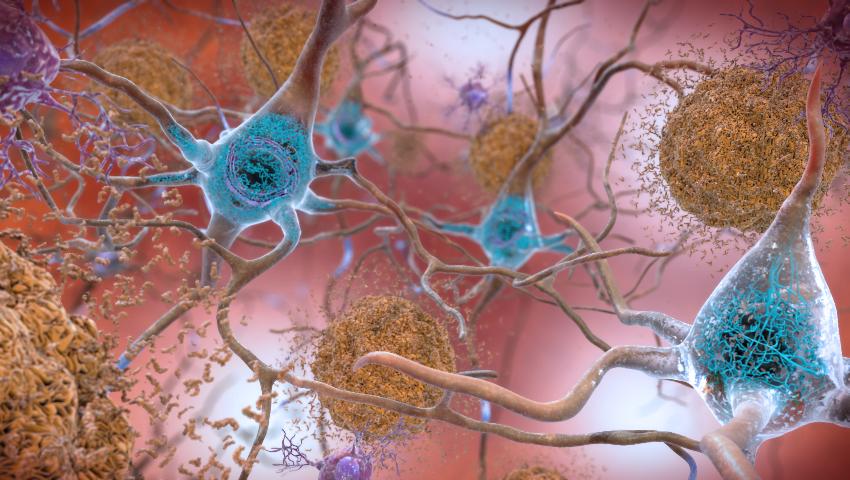
Siendo sinceros, la causa de este trastorno neurodegenerativo aún es desconocida, aunque inicialmente se culpabilizó a las proteínas beta-amiloides y posteriormente a las proteínas tau, de momento ambas solo siguen siendo un signo de la enfermedad, aunque su análisis específico no se usa comúnmente como diagnóstico. Pero un nuevo trabajo presentado en Chicago durante la Conferencia Internacional de la Asociación de Alzheimer 2018 (AAIC) apunta a un origen totalmente diferente al cerebro: el hígado. Según los investigadores una clase de lípidos, o grasas, producidas por el hígado llamadas plasmalógenos, ofrecerían una protección al cerebro, así que si no se produjesen correctamente, llevaría a problemas como las demencias en general o el Alzheimer. Algunos subtipos de estos lípidos parece ser que ayudan al correcto funcionamiento de las uniones neuronales o sinapsis, por lo que una menor cantidad de las mismas podría ocasionar problemas. Por esto investigaron si los niveles reducidos de ciertos plasmalógenos podrían aumentar realmente el riesgo de alzhéimer, así que estudiaron a más de 1.500 personas, divididos en las tres categorías más lógicas que ya hemos comentado anteriormente en diversos ensayos: aquellos que ya se habían diagnosticado Alzheimer, con deterioro cognitivo leve e individuos sanos. Según sus resultados, sí existían diferencias significativas en los niveles de plasmalógenos entre los tres grupos. Aquellos con menos plasmalógenos tenían más riesgo de sufrir deterioro cognitivo leve o Alzheimer. Las investigaciones que relacionan al hígado con un mayor riesgo de alzhéimer, no son nuevas, hace casi una década se detectó que una enzima producida por el hígado sería responsable de proteger al cerebro contra estos problemas, afectando al normal metabolismo cerebral se vería afectado. Dos años después otro estudio indicaba que las proteínas responsables de diversos problemas cognitivos en el alzhéimer tendrían su origen en el hígado, al ser este responsable de fabricar las proteínas, observando que podía ser el responsable de expresar un gen cuyo papel sería clave en el desarrollo de la proteína beta-amiloide. Incluso estudio publicado en 2016 llegó a sugerir una asociación entre el hígado graso no alcohólico y un aumento de riesgo de Alzheimer. Pese a todos estos estudios y el actual, los propios investigadores no pueden confirmar todavía al cien por cien que el hígado pueda llegar a estar detrás de todo, pero sí plantean tras todos estos resultados que las próximas investigaciones, si se quiere mejorar el abordaje y tratamiento, deben enfocarse en buscar otras rutas causales del alzhéimer, abriendo nuevas puertas a unos estudios que en los últimos años parecían haber llegado a callejones sin salida, principalmente por desconocer un factor básico como era el desarrollo temprano de la enfermedad y que ahora ha quedado asumido. Y con esto terminamos la primera parte sobre los progresos que este último año están cercando a una de las enfermedades más devastadoras del siglo XXI, pero que poco a poco las noticias están abriendo un camino a la esperanza, así que nada mejor que este reportaje para iniciar el año. Feliz Año Nuevo. (En la imagen de portada: En el cerebro afectado por la enfermedad de Alzheimer, los niveles anormales de la proteína beta-amiloide se agrupan para formar placas (vistas en marrón) que se acumulan entre las neuronas y alteran la función celular. Las colecciones anormales de la proteína tau se acumulan y formando “ovillos enredados” (vistos en azul) dentro de las neuronas, dañando la comunicación sináptica entre las células nerviosas. Algunas de las evidencias sugieren que los cambios cerebrales relacionados con la enfermedad de Alzheimer pueden resultar de una interacción compleja entre las proteínas tau y beta-amiloides anormales y otros factores varios. Parece que la proteína tau anormal se acumula en regiones específicas del cerebro involucradas con la memoria., mientras que la Beta-amiloide se agrupa en placas entre las neuronas. A medida que el nivel de beta-amiloide alcanza un punto de inflexión, hay una rápida propagación de la proteina tau por todo el cerebro. Autor: National Institute on Aging,NIH) Te puede interesar:
Autor: Juan Carlos Fernández
Temas relacionados: Divulgación científica, Biomedicina, Medicina, Pastillitas De Ciencia Reconocimientos y más información sobre la obra gráfica ADVERTENCIA: En este foro, no se admitirán por ninguna razón el lenguaje soez y las descalificaciones de ningún tipo. Se valorará ante todo la buena educación y el rigor sobre el tema a tratar, así que nos enorgullece reconocer que rechazaremos cualquier comentario fuera de lugar.
0 Comentarios
Deja una respuesta. |