MEDICINA |
|
|
Pastillitas de Ciencia: Hoy Alzheimer
Continuamos explorando los trabajos del último año y las próximas apuestas de la investigación en 2019 en la lucha contra una de las enfermedades que determinarán nuestro futuro conocimiento del cerebro y marcarán el camino de la ciencia.
Nuevos mecanismos implicados en el alzheimer: Una proteína provoca el fallo de otra que está implicada en la memoria y el aprendizaje
Tras la tormenta perfecta que supuso el fin del año 2017, estaba claro que la investigación abordaba el problema demasiado tarde, es decir, en fases demasiado tardías de la enfermedad, cuando la bola de nieve ya hacía años que había comenzado a rodar y ni siquiera todos los mecanismos estaban cerca clarificarse, así que era hora de comenzar a reflexionar. Ya hemos comentado la relevancia que suponía el hallazgo de las implicaciones con la proteína tau, pero el puzle ya se vislumbraba que iba a ser más complejo y se abordaron muchos posibles mecanismos involucrados. Así con esta perspectiva, en febrero de 2018 el grupo de Javier Sáez Valero, del Instituto de Neurociencias de Alicante, centro mixto de la Universidad Miguel Hernández y el CSIC, exponían un nuevo trabajo publicado en FASEB Journal: Decreased generation of C-terminal fragments of ApoER2 and increased reelin expression in Alzheimer's disease donde se ofrecía otra pista para resolver el misterio, al descifrar parte del mecanismo por el que la proteína Reelina actúa incorrectamente en su importante función relacionada con la memoria y el aprendizaje, elementos clave en la enfermedad de Alzheimer, observando en las personas con la enfermedad que se debía a un fallo inducido por la proteína beta-amiloide, característica de la enfermedad de Alzheimer. En estudios previos demostraron que los niveles de Reelina estaban aumentados en el cerebro de las personas con enfermedad de Alzheimer, aunque paradójicamente con posterioridad observaron que, a pesar de ese incremento, la Reelina fallaba en sus funciones ya mencionadas en relación con los procesos de memoria y la plasticidad sináptica (Dicha plasticidad, resulta en un proceso por el cual las conexiones entre las neuronas , es decir la sinapsis, nos facilita memorizar, aprender y adaptarnos a situaciones nuevas, estas habilidades se debilitan o refuerzan en función de la experiencia cotidiana, pero son deterioradas con el alzheimer.) En condiciones normales, la Reelina se une a un receptor de las neuronas llamado ApoER2 para realizar su función y a la vez mantener la producción en unos niveles adecuados, pero con el Alzheimer, aunque haya más Reelina, esta no interacciona correctamente con el receptor ApoER2, por culpa de la interferencia de la proteína beta-amiloide, generando un bucle que causa la sobreproducción no útil de Reelina. Además descubrieron que el mecanismo encargado de controlar la proteína Reelina funciona de manera diferente en las personas portadoras del alelo ApoE4, que es el principal factor genético de riesgo para padecer alzheimer, por tanto ApoE4 parecía interferir de forma adicional en el control de la proteína Reelina.
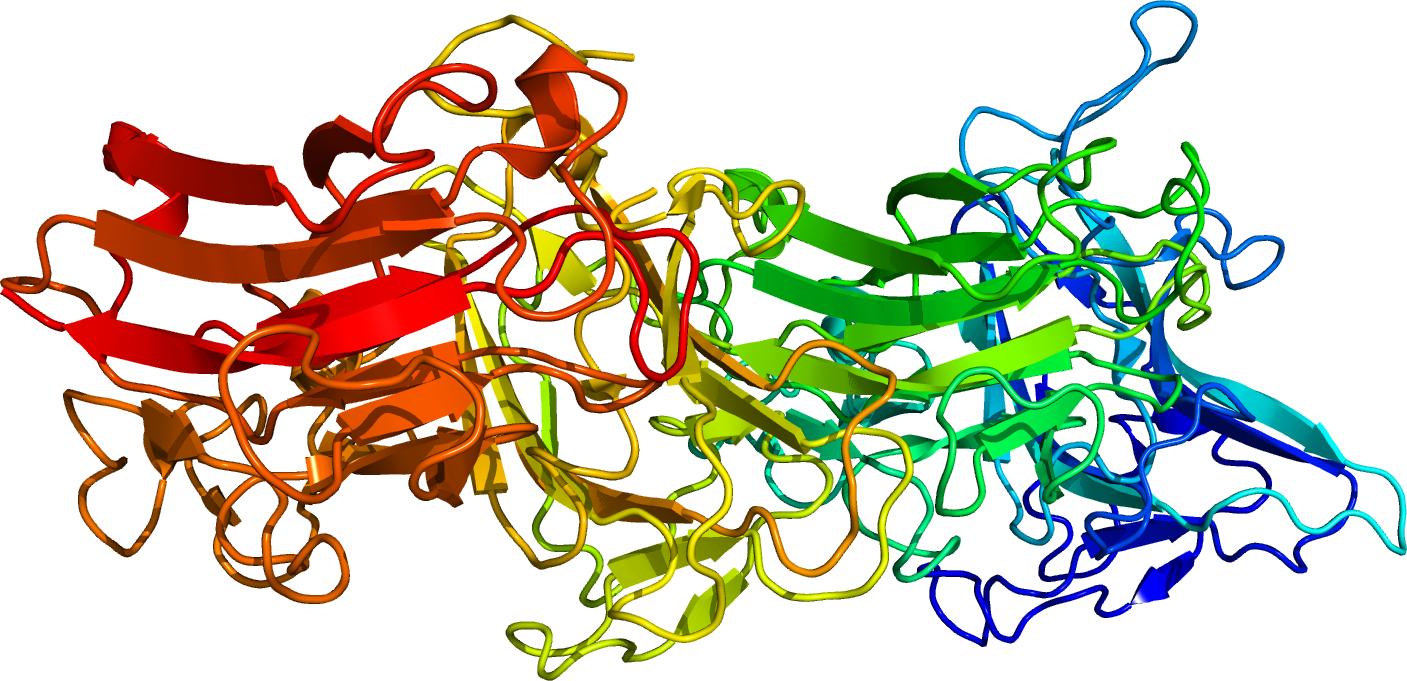
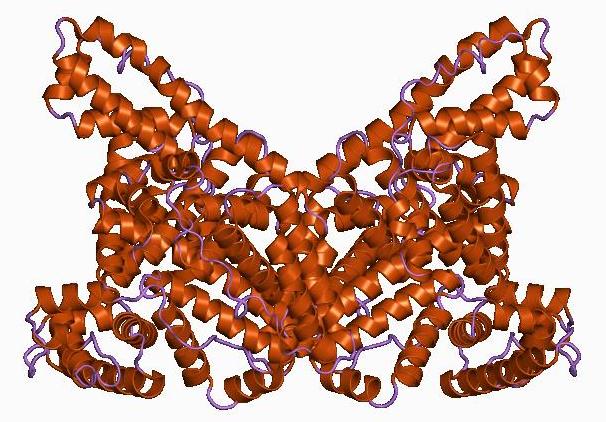
Estructura cristalográfica de la proteína reelina situada en las coordenadas PDB: 2e26. Imagen: Boghog
Ahora el esfuerzo en esta investigación se centrará en ApoE, con el objeto de descifrar si la propensión a desarrollar esta enfermedad neurodegenerativa tiene que ver con estos fallos en la Reelina, intentando aclarar estas alteraciones, ya que pueden afectar a la capacidad de la Reelina para proteger al cerebro contra la toxicidad de la proteína beta-amiloide característica de la patología. Identificación de biomarcadores Hasta ahora los dos biomarcadores más fiables para realizar un diagnóstico precoz de Alzheimer son la concentración de la proteína beta-amiloide y de proteína tau fosforilada en el líquido cefalorraquídeo, aunque, como ya comentamos en la primera parte, no todos los casos donde aparecen estas alteraciones significa que acaben desarrollando la enfermedad. Así que los investigadores se esfuerzan en encontrar nuevos biomarcadores que permitan revelar sin dudas la enfermedad en los diferentes estadios, detectándola lo más prematuramente posible para tratarla adecuadamente según el caso. En abril el esfuerzo por obtener mecanismos tempranos para detectar la enfermedad, (algo crucial como ahora sabemos), avanzaba con el trabajo de un equipo científicos liderado por Natàlia Carulla del Instituto de Investigación Biomédica (IRB Barcelona) y del Institut Européen de Chimie et Biologie (IECB) en Francia. Por primera vez demostraban la unión estable de dos proteínas (dímero) en cerebros de enfermos de Alzheimer, lo cual podría suponer un potencial biomarcador y un posible camino para una diana terapéutica. El trabajo, que se publicó en la revista Analytical Chemistry, demostraba que este enlace de dos moléculas de proteínas del tipo beta-amiloide era estable y muy fuerte (formado por enlaces covalentes) y difícil de romper durante los análisis de laboratorio donde se manipulaba para su extracción y la obtención de muestras del cerebro.
Uno de los principales retos de la ciencia actual es el diagnóstico precoz y el desarrollo de tratamientos para enfermedades neurodegenerativas como el alzheimer, cuyo riesgo se incrementa con la edad pero comienza a desarrollarse muchos antes. A causa de la actual esperanza de vida, cada vez más larga y una población cada vez más envejecida, supone un grave problema. Así pues, la investigación básica es fundamental para desarrollar marcadores y terapias. Pixabay
Hasta entonces se desconocía si las dos moléculas de beta-amiloide formando el dímero estaban unidas entre sí por un enlace químico o no, algo importante porque, si no, se podría romper la unión durante la manipulación de las muestras para analizarlas en el laboratorio y su concentración no se podría medir con precisión. Analizando muestras de los cerebros se propuso que estos dímeros podrían ser la especie patológica más pequeña que desencadenara la enfermedad de Alzheimer. Ahora, el siguiente paso en el que trabajan será comprobar si se pueden encontrar en líquido cefalorraquídeo y después, realizar ensayos clínicos que relacionen presencia e intensidad con el desarrollo del Alzheimer realizando pruebas en pacientes vivos. Se espera con este hallazgo poder validar los dímeros como biomarcadores para el Alzheimer a través de un método robusto y fiable que permita el análisis del dímero en diferentes tipos de muestras con colaboración del equipo de espectrometría de masas liderado por Marta Vilaseca. Nuevas terapias y fármacos A lo largo de todo el año 2018 y para su estudio en el próximo 2019 se han propuesto una larga lista de nuevas terapias e incluso vacunas, pero no es oro todo lo que reluce, periódicamente los medios de comunicación de manera bastante espectacular y no negaremos que algo manipuladora suelen anunciar el hallazgo de la terapia o la vacuna que será la definitiva contra esta enfermedad. Por desgracia esto no es tan sencillo y es un proceso de comprobación bastante lento pero hemos intentado hacer una selección de los tratamientos y vacunas más interesantes y prometedores que se anunciaron en 2018 y se espera evaluar en 2019. Una vacuna para reducir las placas tóxicas que causan el Alzheimer Comenzamos con una vacuna anunciada en noviembre, al parecer ya probada con éxito con animales en Estados Unidos que reduce la acumulación en el cerebro de los dos tipos de proteínas tóxicas que desencadenan la enfermedad de Alzheimer. El siguiente paso ahora es probar su eficacia en humanos tras certificar su seguridad. Eso es lo que afirman los desarrolladores liderados por la doctora Doris Lambracht-Washington, autora principal de este proyecto en el Southwestern Medical Center de Utah y el doctor Roger Rosenberg director del Centro de la Enfermedad de Alzheimer en la misma localidad, sobre esta prometedora vacuna cuyo desarrollo ha durado diez años, donde las primeras pruebas con ratones han demostrado que es capaz de atacar de manera efectiva y segura lo que creen que puede causar la enfermedad de Alzheimer.
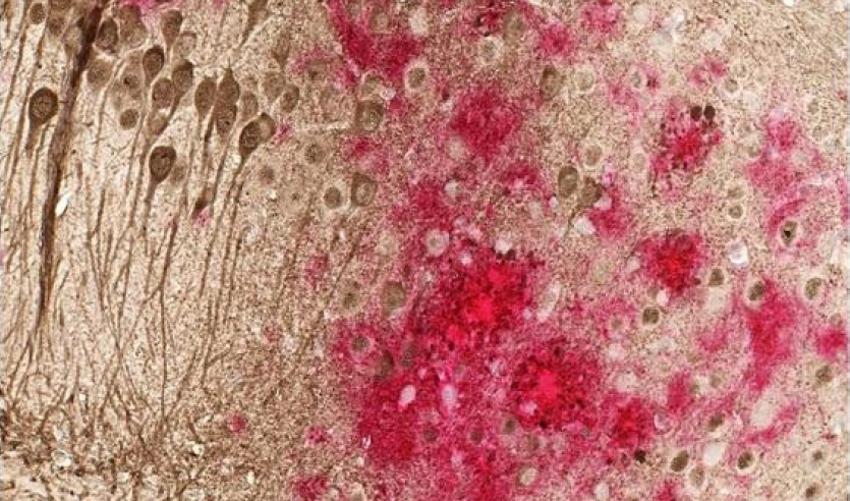
Imagen donde observamos un lámina del cerebro de un ratón modelado para tener la enfermedad de Alzheimer, donde podemos observar cómo se forman placas tóxicas de amiloide (de color rojo) y ovillos de tau (color marrón). Southwestern Medical Center
Al parecer los ensayos con animales de laboratorio, en un principio ratones y monos, muestran que esta vacuna provoca una respuesta inmune en el cuerpo, reduciendo la acumulación de las dos proteínas tóxicas en el cerebro asociadas con el Alzheimer (en el último ensayo con ratones, provocó una reducción del 40% de la proteína beta-amiloide y del 50% en la tau, sin provocar la inflamación del cerebro.) En las pruebas con animales, la respuesta inmune que provoca la vacuna ataca y mata las células del cerebro afectadas por las dos proteínas tóxicas tau y beta-amiloide cuya acumulación provoca la enfermedad de Alzheimer en humanos, pero al parecer sin provocar efectos secundarios graves, como ya había ocurrido con otro ensayo de vacunas hace 16 años, que causaba inflamación cerebral en los pacientes. Ahora falta comenzar las pruebas en humanos y corroborarlo. Avance en la ralentización del Alzheimer en un ensayo con pacientes en estado moderado En lo que respecta a España durante el pasado año, probablemente en ensayo clínico más prometedor para la búsqueda de una terapia proceda de Grifols, quienes presentaban a finales de octubre los resultados de un trabjo que abría la esperanza para los enfermos de Alzheimer, al menos los que presentan la dolencia todavía en un estado moderado. Según destacaba el doctor Antonio Páez, director médico de Grifols y responsable del programa clínico, el ensayo, bautizado con el nombre de AMBAR (Alzheimer Management By Albumin Replacement) había mostrado un retraso significativo en el avance de la enfermedad. En el programa participan La Fundació ACE en Barcelona (España) y el Alzheimer Disease Research Center de la Universidad de Pittsburgh (EEUU), que colaboran con Grifols desde que la compañía puso en marcha su estrategia integral de investigación en Alzheimer en 2004. Los Investigadores de ambas instituciones citadas han elogiado los resultados, destacando que estos hallazgos científicos permiten abrir una nueva era en la lucha contra el alzheimer.
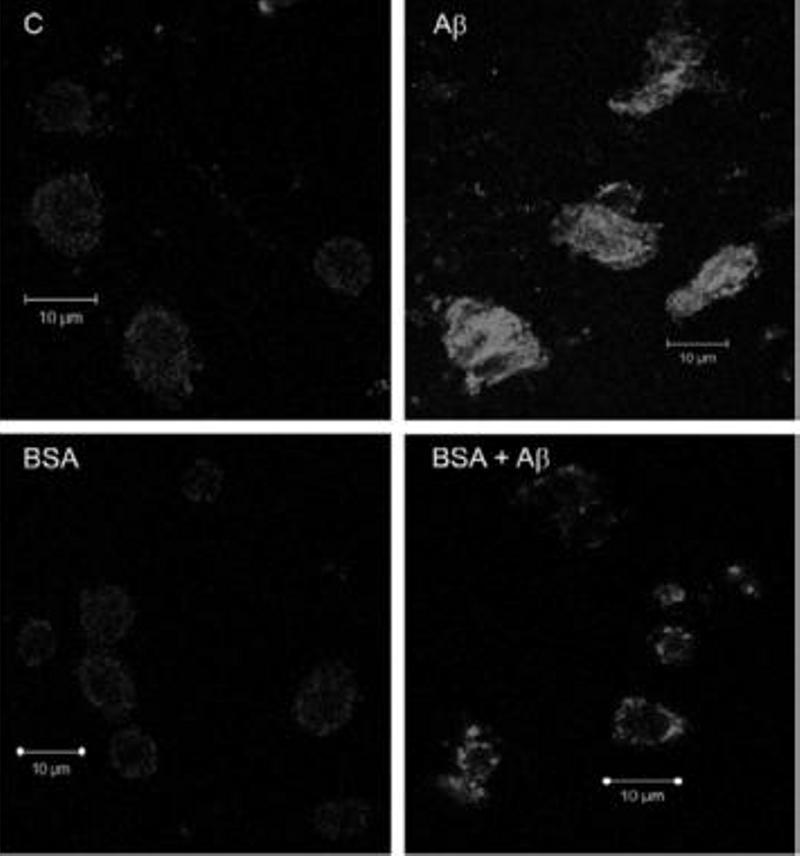
Beta-amiloide en el interior de la célula (arriba derecha), que se queda en el exterior con albúmina (abajo derecha). La parte izquierda es un grupo de control. Journal of Alzheimer's Disease.
¿Pero son tan positivos? El procedimiento, que implica la extracción de plasma mediante plasmaféresis y su sustitución con albúmina (una proteína plasmática con múltiples propiedades terapéuticas) ha mostrando una ralentización de la progresión de la enfermedad en los pacientes en un estadio no muy avanzado. Las cifras del ensayo han demostrado una ralentización del 61% en la progresión de la enfermedad, logrando los objetivos principales de eficacia establecidos en mejora cognitiva y capacidad para las actividades de la vida diaria. Ahora bien en el grupo de pacientes con Alzheimer en estadio más leve los resultados también sugieren una ralentización en el progreso de la enfermedad aunque no se alcanzan valores que puedan validarse estadísticamente,. sugiriendo que se necesitaría más tiempo para observar la progresión de la enfermedad en un estadio más leve. Profundizando un poco en el ensayo, el estudio se basa en la hipótesis de que la mayoría de la proteína beta-amiloide, circula en el plasma unida a la albúmina, así que la extracción de dicho plasma unido a la proteína podría desplazar la beta-amiloide del cerebro hacia el plasma, reduciendo el daño que produce el Alzheimer en las funciones cognitivas del paciente. Igualmete, la albúmina podría ser una aproximación multimodal para tratar la enfermedad, por ejemplo por sus propiedades antioxidantes, inmunomoduladoras y antiinflamatorias. En la presentación de los resultado el doctor Óscar López, director del Alzheimer's Disease Research Center de la Universidad de Pittsburgh afirmaba: "El efecto del tratamiento sobre el grupo de pacientes en estadio moderado es muy destacable. Estos hallazgos abren nuevas vías para la investigación de los trastornos neurodegenerativos en adultos y pueden ofrecer a los pacientes con Alzheimer una nueva modalidad de tratamiento".
Estructura de la albúmina sérica. La electroforesis común separa a las proteínas plasmáticas en seis fracciones: albúmina, alfa 1, alfa 2, beta 1, beta 2 y gammaglobulinas. Estos grupos de globulinas involucran dentro de cada uno de ellos una gran cantidad de otras proteínas de migración electroforética similar. Así pues, las albúminas son una familia de proteínas globulares, la más común de las cuales son el suero albúminas. Todas las proteínas de la familia de la albúmina son solubles en agua, moderadamente solubles en soluciones salinas concentradas y experimentan desnaturalización por el calor. Las albúminas se encuentran comúnmente en el plasma sanguíneo y se diferencian de otras proteínas de la sangre en que no están glicosiladas. Jawahar Swaminathan and MSD staff
"Estamos muy satisfechos con los resultados y los celebramos como una bocanada de aire fresco que brinda esperanza a los pacientes con alzheimer y sus familias. Es uno de los avances más significativos en pacientes en estadio moderado que he visto en los últimos 15 años", según la doctora Mercè Boada, Directora de la Fundaciò ACE. "Como médico clínico, también es importante tener en cuenta que este procedimiento es seguro y factible. Hemos realizado más de 1.000 recambios plasmáticos en nuestro centro y cerca de 5.000 en total en el estudio", añadía Boada. El estudio AMBAR ha sido un ambicioso ensayo clínico internacional liderado por Grifols, multicéntrico y doble ciego en el que han participado pacientes con Alzheimer en estadio leve y moderado de 41 hospitales europeos y estadounidenses, participando 496 pacientes con una edad de los participantes entre 55 y 85 años, asignados de manera aleatoria a tres grupos de tratamiento más un cuarto grupo control (placebo). El estudio se diseño para analizar la eficacia y la seguridad del recambio plasmático como tratamiento capaz de ralentizar la progresión de la enfermedad en pacientes con un estadio leve o moderado. Nuevos fármacos para 2019 Para este año gran parte de las expectativas se focalizan Aducanumab, fármaco que se presenta a través de la multinacional estadounidense Biogen, especializada en la investigación y desarrollo de terapias para el tratamiento de enfermedades neurodegenerativas, hematológicas y autoinmunes. La notoriedad de este nuevo fármaco ha sido confirmada en un informe publicado por la consultora Evaluate para el próximo año, especializada en industria de farmaceútica donde lidera el ránking con sus ambiciosos ensayos clínicos junto con cuatro multinacionales más (dos estadounidenses, una danesa y otra belga) La empresa espera tener resultados positivos con su nuevo fármaco para eliminar el alzheimer, a finales de 2019 o principios del 2020. En anteriores fases, las investigaciones ya constataron que los pacientes que recibieron dosis más altas con este tratamiento vieron prácticamente eliminadas las placas beta-amiloides del tejido cerebral, que son como sabemos, las responsables de la muerte de las células nerviosas. Hasta el momento, ningún fármaco ha podido detener eficazmente el alzheimer y tan solo uno ha llegado hasta ahora al mercado con resultados limitados, pronto veremos que mejoras ofrece. Entendiendo nuestro cerebro y estudiando como la enfermedad se propaga En el ámbito de la investigación un proyecto realizado en Standford y liderado por la doctora Ellen Kuhl destacaba a final de año por ser el primero en su campo, en dicho trabajo un equipo de científicos desarrollaban por primera vez una simulación por ordenador. En el resultado de la investigación donde se podía observar cómo grupos de proteínas defectuosas en enfermedades neurodegenerativas como el Alzheimer y la ELA (Esclerosis Lateral Amiotrófica, otra enfermedad del sistema nervioso central, caracterizada por una degeneración progresiva de las neuronas) se propagan a través del cerebro, la mayor parte de ese tiempo sin que nos demos cuenta durante periodos que pueden alcanzar los 30 años.
La simulación por computadora muestra cómo se propagan dos formas de la enfermedad de Alzheimer a través del cerebro en un período de 30 años. El tono naranja muestra cómo grupos de proteínas beta-amiloides defectuosas forman placas que destruyen la memoria. El sombreado azul muestra cómo los defectos relacionados con la proteína tau siguen una progresión diferente. Las secuencias finales muestran cómo cada uno de estos contagios envuelve el cerebro. Universidad de Stanford
Este nuevo trabajo pionero en el abordaje de estas enfermedades, donde los científicos modelaron la progresión de las dos proteínas de plegamiento incorrecto, anteriormente ya citadas: tau y beta-amiloide, podría ayudar a encontrar formas de diagnosticar y tratar estos trastornos neurodegenerativos desde el punto de vista de la comprensión del desarrollo en fases tempranas. . Cambios en el cerebro durante primeras etapas del Alzheimer Como acabamos de decir, para descubrir nuevos biomarcadores y abordajes terapéuticos ya sabemos lo crucial que resulta identificar cambios tempranos en el cerebro a causa de la enfermedad, por lo que el siguiente trabajo que comentamos, recién salido a la luz en diciembre, resulta especialmente significativo. En la investigación, publicada en la revista Neurobiology of Disease, el equipo de la Universidad del Este de Finlandia descubrieron nuevos cambios que ocurren en el cerebro durante en las primeras etapas de la enfermedad de Alzheimer. No era el primero hasta hoy, ya se han realizado varias investigaciones intentando analizar los cambios que se producen en la expresión de ARN de los genes del cerebro de las personas con enfermedad de Alzheimer, pero hasta el momento muy pocos estudios se han centrado en el proteoma completo, el cual abarcaría todo el conjunto de proteínas expresadas en las células. En el transcurso de la investigación recurrieron a los recursos archivados en un biobanco finlandés de muestras de tejido cerebral, clasificadas según la acumulación de proteína tau. Se realizó un análisis del genoma de las muestras para detectar cambios en la fosforilación de proteínas, ARN y proteínas, realizando análisis neurobiológicos por medios informáticos, observando asociaciones de cambios funcionales en ciertos tipos de células cerebrales con la acumulación de proteína tau fosforilada. Ahora tras los resultados obtenidos, la investigación en el nuevo año se centrará en explorar si los cambios cerebrales recién descubiertos en las diferentes etapas de la enfermedad también son visibles en el líquido cefalorraquídeo y en las muestras de sangre, considerando si podrían usarse como nuevos biomarcadores predictivos del Alzheimer. Blue Rain, un proyecto diferente y ambicioso Sin duda uno de los proyectos de los que hablaremos en 2019 y que destacan en todos los sentidos es Blue Brain, un proyecto internacional en el que además participa España con la intención de mapear nuestro cerebro y descifrar las claves de su funcionamiento, facilitando así acabar con múltiples enfermedades neurodegenerativas como la que nos ocupa. Como sabemos, el cerebro está formado principalmente por el tejido nervioso, el cual no es un sistema continuo, si no un conjunto de millones de células individuales, las neuronas, las cuales forman un complejísimo sistema con regiones y funciones especializadas. Pero desde que a finales del siglo XIX Santiago Ramón y Cajal describiera la estructura básica del sistema nervioso, los investigadores llevan más de un siglo intentando desentramar el complejísimo funcionamiento del cerebro humano. Así parte este ambicioso proyecto con participación española de 30 investigadores encabezados por Javier de Felipe, profesor de investigación en el Instituto Cajal (CSIC) y José́ María Peña, director de CeSViMa (Centro de Supercomputación y Visualización de Madrid) contando para ello con el supercomputador Magerit, el más potente de España, cedido por el CeSViMa. El proyecto denominado Blue Brain que tiene sus comienzos en el año 2005, cuando el neurocientífico Henry Markram, profesor en la École Polytechnique Fédérale de Lausanne en Suiza, se propuso recrear digitalmente una pequeña parte del tejido nervioso para comprender la interacción de las neuronas simulando por ordenador las conexiones sinápticas, es decir emular digitalmente, el intrincado recorrido de las corrientes eléctricas que transmiten los impulsos nerviosos entre las neuronas.
Este estudio supone el primer intento de aplicación ingeniería inversa para conocer los entresijos del funcionamiento del cerebro. La ingeniería inversa, es algo muy conocido por ejemplo en programación o el espionaje industrial, trata de entender como está programado o construido algo a partir de información suministrada por el producto final o el programa comercial resultante con el objetivo de reproducirlo sin pagar derechos de propiedad intelectual o patentes.
En este caso debemos entender al cerebro, como el producto a estudiar, sin duda la más compleja, ordenada y fascinante estructura de materia conocida en el universo, hay que determinar su estructura y la manera en que sus elementos (neuronas) se distribuyen, conectan e interactúan entre sí. Sin duda este es el desafío de ingeniería inversa más importante al que se ha enfrentado jamás ningún ingeniero o investigador en todo el planeta, porque el cerebro humano tiene aproximadamente cien mil millones de neuronas, por si fuera poco, se calcula que a su vez cada una tiene entre 5.000 y 50.000 conexiones sinápticas con sus células vecinas. Lo cual equivale a una red neuronal intercomunicada por 100.000.000.000.000 conexiones.
Infografía de un cuerpo celular del que emergen multitud de neuritas (expansiones del soma de una neurona, es decir cualquier dendrita o axón). Nicolas P. Reugier.
La hipótesis de la que parte Blue Brain es que la corteza cerebral se organiza a partir de la repetición ordenada de la columna cortical o hipercolumna, una estructura básica del cerebro en la que hay cientos de neuronas. De este modo, si las predicciones son correctas y el modelo resultante diseñado a partir de esta hipótesis de configuración logrará reproducir una parte del tejido cerebral, con el tiempo se podría estudiar y predecir el comportamiento de todo tejido nervioso, así como las disfunciones del mismo. Este proyecto facilitaría por ejemplo el entendimiento de cómo afecta a la anestesia al cerebro o en nuestro caso el origen, progresión del Alzheimer y otras enfermedades neurodegenerativas así como los efectos de los diferentes tratamientos a experimentar. La reconstrucción digital del cerebro permitiría experimentar de forma segura en el ordenador con diferentes estímulos para estudiar los procesos cognitivos, como la formación de recuerdos o las lesiones en la corteza cerebral.
Protegiéndonos del Alzheimer: la Irisina y la actividad física
Bien es conocido a estas alturas la importancia de una vida sana, ejercicio y actividad intelectual para prevenir su aparición o ralentizarlo, estadísticamente es algo que difícilmente se puede discutir pero necesitamos conocer los mecanismos que llevan a este beneficio. A comienzos de enero de este mismo año se publicaba en Nature una investigación entre la Universidad Federal de Río de Janeiro (Brasil), la Universidad de Queen en Kingston (Canadá) y la Universidad Columbia en Nueva York (EE.UU.) en dicho trabajo se llevaron a cabo experimentos con ratones que demostraban que la irisina, una hormona producida por los músculos al hacer ejercicio físico, protege del deterioro cognitivo causado por el alzheimer. Los investigadores responsables, Ottavio Arancio, Sergio Ferreira y Fernanda de Felice, demostraron que el aumento de dicha sustancia, así como de su proteína precursora FNDC5, reducía el déficit de memoria y aprendizaje en ratones con la enfermedad., abriendo otra vía a una posible terapia para mejorar la memoria en pacientes de alzheimer, incluidos los que tienen una edad avanzada y no pueden ya beneficiarse de los efectos positivos de la actividad física. Los miembros del equipo observaron que el cerebro de personas y ratones también produce irisina y con la edad aumenta la cantidad de irisina producida en el cerebro, concretamente en la zona del hipocampo, que es justamente la relacionada con el aprendizaje y la memoria. Pero se observó que en pacientes humanos y ratones con alzheimer, la irisina que se genera disminuye radicalmente. Al realizar experimentos en ratones con Alzheimer los investigadores ratificaron como la práctica de ejercicio físico aumenta los niveles de irisina en el hipocampo, protegiéndolos frente a los daños que causa la enfermedad en las neuronas. Tal efecto se demostró también de otra manera: bloqueando la capacidad de producir irisina en esta región del cerebro, con lo cual, la actividad física perdía su efecto protector, probando la necesidad de dicha sustancia para obtener beneficios sobre la memoria. Si por el contrario, en los ratones con alzheimer, se estimulaba la producción de irisina, el cerebro disponía del efecto protector del ejercicio físico. Todavía no está del todo claro cuál es la asociación exacta entre la irisina que segregan los músculos y la que se produce en el cerebro, pero el trabajo establece por fin de manera pionera un mecanismo que relaciona directamente el ejercicio con la prevención del alzheimer. Ahora debemos ver nuevos estudios que confirmen los resultados en animales y personas.
Novedades en Alzheimer, lecturas recomendadas adicionales
Frente a los fracasos de los últimos tiempos, el año 2018 podríamos considerar que ha supuesto un repunte de esperanza en la lucha contra el Alzheimer con nuevos abordajes y resultados más que satisfactorios que incitan a pensar que será un gran año para combatir esta dolencia. Tras leer la segunda parte del reportaje sobre para quienes aún estén interesados en saber un poco más de lo que nos ha deparado los últimos doce meses aquí os dejamos un interesante resumen de acceso a contenido altamente aconsejable: Estrés y ovillos de proteína tau https://www.sciencedaily.com/releases/2018/08/180822092706.htm En este interesante artículo de agosto de 2018 publicado enScience Daily el equipo del Centro de Ciencias de la Salud en la Universidad de San Antonio, (Texas) descubrió que el estrés, (senescencia celular), está asociado con los conocidos ovillos de proteína tau dañinos y que son un sello distintivo de 20 enfermedades cerebrales humanas, como el Alzheimer y la lesión cerebral traumática. En el estudio han establecido un vínculo entre estas marañas de proteína tau y el estrés celular. Los científicos utilizaron una terapia senolítica para eliminar las células senescentes y las marañas tau en los ratones con Alzheimer, lo que mejoró tanto la función cerebral como la estructura. Eliminación completa de las placas amiloides, relacionadas con la enfermedad de Alzheimer en ratones http://jem.rupress.org/cgi/doi/10.1084/jem.20171831?PR Hablamos ahora del trabajo del equipo de científicos del Instituto de Investigación Lerner de Cleveland Clinic descubrió que la disminución gradual de una enzima llamada BACE1 invierte por completo la formación de placas amiloides en el cerebro de ratones con la enfermedad de Alzheimer, mejorando así la función cognitiva de los animales. Este es como sabemos uno de los primeros eventos en la enfermedad de Alzheimer: la acumulación anormal del péptido beta amiloide, que puede formar placas en el cerebro y alterar la función de las sinapsis neuronales. BACE1 ayuda a producir el péptido beta amiloide mediante la escisión de la proteína precursora amiloide (APP). Así que el uso de fármacos que inhiban BACE1 son una gran esperanza, el obstáculo de momento a superar es que BACE1 controla muchos procesos importantes y los medicamentos podrían tener importantes efectos secundarios. De febrero de 2018, resulta un trabajo ya con cierto tiempo pero este estudio, publicado en Journal of Experimental Medicine, abre la puerta a que medicamentos dirigidos a esta enzima, puedan tratar con éxito la enfermedad de Alzheimer en humanos. El ajedrez previene el Alzheimer al estimular la memoria y la concentración http://www.xn--puol-1oa.es/index.php/es/cultura-educacion/7847-departamento-de-comunicacion-7847?templateStyle=147 Ya conocemos de sobra la necesidad intelectual para prevenir el Alzheimer y combatir sus efectos pero existe una práctica especialmente entretenida y beneficiosa: el ajedrez Así que el Hospital Clínico de Valencia, en colaboración con la Federación Valenciana de Ajedrez realizó un estudio entre personas de la tercera edad. El estudio ha demostrado cómo la práctica de este juego interviene en la prevención del Alzheimer, incluso más que otros juegos memorísticos. Este ha resultado un estudio pioneros bajo la dirección de la doctora especializada en neuropsicología, Dª Isabel de la Fuente, y la colaboración de Don Mauricio Vasallo que confirma las sospechas sobre el beneficio de este gran deporte intelectual.
En este estudio se trataba de buscar la posible relación del ajedrez como método preventivo frente al Alzheimer, y sus beneficios en el retardo y nivel de gravedad en aquellas personas en que aparecían sus primeros síntomas. Por lo que se seleccionaron a 120 personas de los CEAM de Torrent, Jorge Juan, Islas Canarias y Cabañal, con edades comprendidas entre 55 y 87 años, si bien el 75% de ellos tenía entre 65 y 79 años con resultados más que satisfactorios que reafirman los beneficios de este antiguo y noble juego.
La música activa regiones del cerebro preservadas por la enfermedad de Alzheimer https://scienmag.com/music-activates-regions-of-the-brain-spared-by-alzheimers-disease/ Otro interesante artículo de Sciencie Magazine que confirma las bondades de la música. ¿Alguna vez te da escalofríos escuchar una pieza musical particularmente conmovedora? Puedes agradecer a la red de atención del cerebro por esa respuesta emocional. Sorprendentemente, esta región también sigue siendo una isla de recuerdo que se salva de los estragos de la enfermedad de Alzheimer. Investigadores de la Universidad de Utah están investigando en esta región del cerebro para intentar desarrollar nuevos tratamientos basados en la música para ayudar a aliviar la ansiedad en pacientes con demencia. La investigación apareció en la edición on-line de abril 2018 de The Journal of Prevention of Alzheimer's Disease accesible desde aquí: http://healthsciences.utah.edu/
Brain Network Lab
Mecanismo que conduce a mutaciones neuronales en la enfermedad de Alzheimer https://www.nature.com/articles/d41586-018-07334-9 Las mutaciones genéticas pueden surgir no solo en los óvulos fertilizados, que afectan a todas las células de un organismo, sino también en un subconjunto de células de un organismo. Este último fenómeno, llamado mosaicismo, prevalece en el cerebro y se ha asociado con varios trastornos neurológicos, incluida la enfermedad de Alzheimer esporádica, la forma más común de la enfermedad. Ya en 2015, se descubrió que las neuronas de personas con Alzheimer contenían más ADN y tenían más copias de la proteína precursora de la amiloide-β (APP) relacionada con el Alzheimer que las neuronas de personas sin la enfermedad. Sin embargo, los cambios genómicos exactos subyacentes a este mosaicismo quedaron sin resolver. Ahora los investigadores hacen un seguimiento de ese trabajo, proporcionando un mecanismo para aumentar el mosaicismo de APP en los cerebros de las personas con enfermedad de Alzheimer esporádica. Así pues, el estudio podría alterar nuestra comprensión de las raíces de la neurodegeneración. Interesante investigación publicada en Nature para adentrarnos un poco más en los mecanismos que conducen a las mutaciones cerebrales en la enfermedad de Alzheimer.
PLOS.org
Un apunte retrospectivo ¿Puede realmente el Alzheimer robarnos la conciencia? https://blogs.plos.org/neuro/2017/04/03/can-alzheimers-disease-steal-ones-consciousness/ https://www.ncbi.nlm.nih.gov/pubmed/11696024 Para terminar y de una manera más general sugerimos una lectura un tanto especial, (se basa en un artículo de 2017 y un estudio neuropsicológico de 2001 sobre los diversos aspectos de la propia consciencia humana en la enfermedad de Alzheimer.) A pesar de tener algo de tiempo nos ayudará a reflexionar sobre la complejidad y la sorprendente capacidad del cerebro para enfrentarse a la adversidad y proteger nuestro “yo”. Podríamos decir que la enfermedad de Alzheimer se ha caracterizado como una "pérdida completa de uno mismo". Al principio, cuando la memoria comienza a desvanecerse, el paciente tiene dificultades para recordar nombres, su lista de la compra o dónde colocan sus llaves. A medida que avanza la enfermedad, tienen problemas para mantenerse enfocados, planificar y realizar las actividades básicas diarias. Visto desde el exterior, la demencia parece devastar el intelecto y la personalidad de uno, sin embargo, como meros observadores, resulta imposible determinar cómo la enfermedad transforma gradualmente la conciencia del yo y del entorno. El célebre neurólogo Oliver Sacks sugirió una vez que: "El estilo, neurológicamente, es la parte más profunda de nuestro ser y puede conservarse, casi hasta el final, en la demencia". ¿Es este "estilo" neurológico restante suficiente para preservar la conciencia? ¿Está el paciente con EA consciente de su deterioro cognitivo, conservando un sentido de identidad o moralidad, o todavía puede conectarse con amigos y seres queridos? Los últimos avances en neurociencia han permitido a los investigadores explorar con mayor precisión el cerebro de los pacientes con Alzheimer, lo que sugiere que, aunque algunos aspectos de la conciencia están comprometidos por la enfermedad, otros se salvan notablemente. Te puede interesar:
Autor: Juan Carlos Fernández
Temas relacionados: Divulgación científica, Biomedicina, Medicina, Pastillitas De Ciencia Reconocimientos y más información sobre la obra gráfica ADVERTENCIA: En este foro, no se admitirán por ninguna razón el lenguaje soez y las descalificaciones de ningún tipo. Se valorará ante todo la buena educación y el rigor sobre el tema a tratar, así que nos enorgullece reconocer que rechazaremos cualquier comentario fuera de lugar.
0 Comentarios
Deja una respuesta. |