TECNOLOGÍA Y CIENCIA |
|
|
Hace unas semanas comenzamos una serie de reportajes sobre dolor crónico y neuroestimulación a partir del conocimiento de un caso con nombre propio: Sergio González, un paciente con un grave caso de Síndrome de dolor regional crónico (SDRC) donde las opciones terapéuticas más convencionales habían quedado agotadas y la opción de un neuroestimulador o quizás la vía intratecal quedaban como únicas opciones.
Queríamos orientar a este paciente, explicar origen, funcionamiento, ventajas y desventajas de los neuroestimuladores, pero comprendimos que traspasar la barrera de la explicación sencilla resultaría muy difícil sin realizar una explicación teórica y profundizar en la terminología, los mecanismos y bases para comprender lo que realmente comprendemos por dolor, así que realizamos la primera y segunda parte centrados en aclararlo, pero ya ha llegado el momento de profundizar en la soluciones más “electrónicas” en este reportaje.
Separando cables Si todavía no conoces muy bien la materia y buscas “estimulación nerviosa” o “neuroestimulación” en Internet probablemente, tras superar el primer escollo que tantas veces me han contado, es decir, comprender el uso apropiado del término “bloqueo” en estos temas (como “detención” o “anulación” de la señal dolorosa) te vas a encontrar con un montón de términos asociados donde darán por hecho que conoces las diferencias, pues están asociados y te van a marear un poco en un principio, ya que encontrarás la neruroestimulación asociada muchas veces a la Estimulación Nerviosa Periférica (ENP), la Estimulación Nerviosa Periférica en Anestesia Regional, la Neurolocalización, la Estimulación de la Médula Espinal (EME), la Neuroestimulación Eléctrica Transcutánea (TENS) que con tanta frecuencia se confunde en un principio cuando buscáis y encontráis mil variantes más que os van a marear y no permitan ir al grano, aunque lo primero de lo primero es saber que todos estos procedimientos según sean unos u otros, tienen dos finalidades a saber y diferenciar: ayudas diagnósticas y ayudas terapéuticas (como el caso del neuroestimulador que por ejemplo es aconsejable en el caso de Sergio González)
Este reportaje inicialmente está realizado para explicar los beneficios de un neuroestimulador de la médula espinal (EME) pero para poder comprender bien su funcionamiento y diferenciarlo de otros dispositivos de este campo de las neurociencias lo mejor es conocer la historia y evolución previa que nos permita distinguir su funcionamiento y utilidad en todas las áreas, pues a día de hoy las diversas modalidades de neuroestimulación permiten no solo paliar el dolor y ayudar a su localización para bloquearlo, si no que ofrece numerosos beneficios para paliar los síntomas de otras enfermedades como el Párkinson. Biblioteca Las Casas / Ruiz Pavón, Eva M.
He escuchado muchas veces la situación de perplejidad que muchas personas experimentan al buscar respuestas documentales respecto a la neuroestimulación, pues si estas ya son profesionales médicos, disponen de antemano de la formación necesaria para alcanzar las fuentes concretas necesarias, pero para un ciudadano medio, las diferentes facetas de la neuroestimulación se entremezclan en Internet de una manera espectacularmente confusa que dificulta poder profundizar en la materia o buscar un apoyo bibliográfico en “papel”. Por tanto he considerado necesario intentar realizar un acercamiento mínimo a los neuroestimuladores procurando diferenciar en un principio las diferentes ramas de una manera amena a modo de relato histórico, que les permita en un futuro si están muy interesados en la materia facilitarles la búsqueda de la documentación más apropiada evitando tediosas pérdidas de tiempo por la confusión. Además he decidido realizar en las próximas semanas también una especie de apéndice diferenciando textos en lengua castellana e inglesa, sobre los diferentes documentos donde podemos complementar la información, puesto que he considerado que una simple referencia bibliográfica al uso, sería del todo insuficiente dada la complejidad del tema y la dificultad existente para encontrar algo parecido fuera de los círculos especializados.
SCS, Estimulación eléctrica medular, EME, ENP, TENS, DBS, Deep Brain Stimulation, SDRC, FBSS, Failed Back Surgery Syndrome… “el universo” de la neruroestimulación comprende un sinfín de términos y aplicaciones que pueden llevarnos a la más completa confusión cuando intentamos documentarnos a ciegas, pudiendo llegar incluso a confundirnos más que antes de comenzar a conocer este amplio abanico biotecnológico.
La extensión de dicho apéndice puede que supere en extensión incluso a la suma de los tres reportajes por lo que he considerado realizar un exhaustivo filtrado de todo aquello a lo que podemos acceder tanto en internet como físicamente de una manera más detallada puesto que no solo será útil respecto a la enfermedad responsable de este reportaje el SDRC, si no de muchas otras donde el dolor representa el eje vertebrador de la dolencia. Así que vamos a intentar simplificarlo y comprenderlo, pues en realidad todo está relacionado y más o menos, hablamos de lo mismo desde distintos puntos de vista, aunque lo que nos interesa a nosotros concretamente de todo eso, son esos “pequeños aparatitos que van a implantarnos y conseguirán bloquear el dolor para que nuestro cerebro no nos informe de tanto sufrimiento inútil y que hace nuestra vida imposible”. Cuando acabes de leer este reportaje y ya tengas claras las diferencias, te aconsejo encarecidamente si te interesa el apasionante mundo que supone el funcionamiento del cerebro y el sistema nervioso te adentres en mirar esos campos paralelos de la neuroestimulación, esenciales para tener un “mapa general” de esta moderna y prometedora disciplina que lucha por acabar con el dolor innecesario. Pues bien, los principios modernos para “bloquear” el dolor y el desarrollo de la anestesia, tanto en términos generales como periféricos comenzaron hace más de un siglo en la medicina moderna, pero para que esta tecnología se haya podido desarrollar plenamente, ha sido necesidad imperativa la evolución de la ingeniería electrónica, la tecnología informática o incluso la nanotecnología, además por supuesto de la propia medicina claro, para así poder alcanzar hoy en día un espectro multidisciplinar que avanza conjuntamente hacía nuevos y emocionantes caminos para ganar la batalla al dolor y la enfermedad. Concretamente el verdadero auge de la neuroestimulación fue influido por el progreso tecnológico en el campo de los marcapasos cardíacos y los avances en los conocimientos fisiopatológicos, la interpretación de estos cuadros clínicos, sobre todo en el tema del dolor, así como el estudio de los primeros resultados clínicos obtenidos mediante neuroestimulación. Así que para desenredar esta maraña de términos en el universo de la neuroestimulación sin aburrirnos, vamos a viajar un siglo atrás y así veremos con facilidad como los descubrimientos, los resultados y las diferentes técnicas desarrolladas en el mundo de la anestesia y la neuromedicina llevaron a estos dispositivos actuales así como que efectos o eficacia tienen realmente en nuestro cerebro y en la percepción del dolor.
Grabado del naturalista holandés Jan Swammerdam (1637-680), donde se describe el procedimiento realizado para la observación de la contracción de un músculo, en la figura 5 se observa el músculo con el nervio anexo, para proceder a continuación a su introducción en un tubo de cristal enganchándolo por los tendones. Universal Images Group
Galvani, electricidad y patas de rana en un mundo sin “chips” Aunque casi todas las historias sobre la neurociencia y estos aparatos suelen comenzar con el médico y físico italiano Luigi Galvani (1737-1831) y sus famosas ranas clavadas en la verja de hierro del patio de su casa , para ser justos, debemos remontarnos al biólogo holandés Jan Swammerdam (1637–1680) , anatomista y zoólogo holandés, conocido principalmente por el estudio de la anatomía y costumbres de los insectos, Swammwerdam estudiaba con microscopios que el mismo fabricaba en los albores de la ciencia óptica, escribiendo obras clásicas como la Historia general de los animales que carecen de sangre o el Libro de la naturaleza pero pocos recuerdan que en sus ideas puso a prueba experimentalmente la hipótesis de los espíritus animales, demostrando que al contraer un músculo mediante la interacción con su nervio, este no se contraía por la “intervención” de los espíritus animales.
Estudio de las contracciones en los músculos de la rana, gravado de Luigi Galvani (1737-1798) DeAgostini Picture Library
Swammerdan abrió nuevos horizontes en la ciencia, al trabajar con nuevos planteamiento y metodologías, intentando demostrar el poder del método reduccionista en la ciencia, donde al analizar una parte de "algo", se puede aprender sobre la organización de ese "algo", pero sin duda fue también el pionero en intentar comprender la verdadera naturaleza entre los nervios y nuestro cuerpo. Aún así hubo que esperar más de 100 años para que Luigi Galvani en 1780, ofreciera la primera demostración de que la electricidad podía estimular los nervios y por tanto era el “elemento que faltaba en la ecuación“ para explicar la razón por la que los elementos de nuestro organismo podían comunicarse entre sí y dar órdenes a los distintos miembros del conjunto, por decirlo de alguna manera. Galvani se esforzaba en sus conferencias por explicar la naturaleza y propiedades de la electricidad, (algo muy novedoso y fascinante por aquella época) para ello realizaba pequeños experimentos prácticos y espectaculares donde por ejemplo aplicando una pequeña corriente eléctrica a la médula espinal de una rana muerta, se producían grandes contracciones musculares en los miembros de la misma o incluso en miembros separados de la propia rana que les hacían saltar igual que si el animal estuviera vivo, provocando la sorpresa y el asombro de los jóvenes estudiantes. Como muchas otras veces en la historia de la ciencia, Galvani había descubierto este fenómeno determinante para la medicina por casualidad, mientras diseccionaba una pata de rana al tocar accidentalmente su bisturí con un gancho de bronce donde colgaba la pata. Aquel contacto fortuito produjo una pequeña descarga y la pata del anfibio se contrajo espontáneamente ante la sorpresa del propio investigador. Fascinado por lo que acababa de presenciar comenzó una serie de experimentos, donde se convenció de que lo que se observaba eran los resultados de lo que llamó "electricidad animal", definiéndola con la fuerza vital que animaba los músculos de la rana.
Pictorial archive from nineteenth-century sources. Dover
Medicina: Historia del dolor y la anestesia, el gran dilema Desde siempre el dolor ha sido un gran problema para la medicina, no ya para bloquearlo cuando existe un trauma o enfermedad, si no cuando había que intervenir a un paciente, el problema de ahorrarle el dolor de la intervención y poder realizarla de una manera tranquila y exitosa era un largo problema en la historia de la medicina que a finales del siglo XIX con los avances en la química y la biología por fin permitió avances significativos. Ya desde la antigüedad pre- cristiana se dieron los primeros pasos en la lucha contra el dolor con el uso de las esponjas soporíferas, basadas en mezclas de mandrágora, beleño u opio. La mandrágora ya fue usada incluso 200 años antes de Cristo por los babilonios. Igualmente el alcohol no se sabe cómo ni cuándo se descubrió, tampoco cuándo se comenzó a utilizar como medicamento contra el dolor, pero también está presente desde los comienzos de la historia al igual que el opio. Desafortunadamente a lo largo de la historia se experimentó con otros medios un poco más, digamos… violentos ya que el ser humano ante la desesperación por combatir el dolor buscó cualquier solución posible, como apretarle el cuello al paciente hasta que éste perdiera el sentido, produciendo anestesia por hipoxia cerebral (reducción del aporte del oxígeno al cerebro), concusión cerebral, golpeando al paciente en la cabeza con un trozo de madera u otro material no contundente en exceso o ya un poco más adelante se experimentó con la aplicación de frío en las zonas a intervenir y la compresión o sección de raíces nerviosas, muy empleada en amputaciones, a partir del cirujano inglés John Hunter (1728 – 1793)
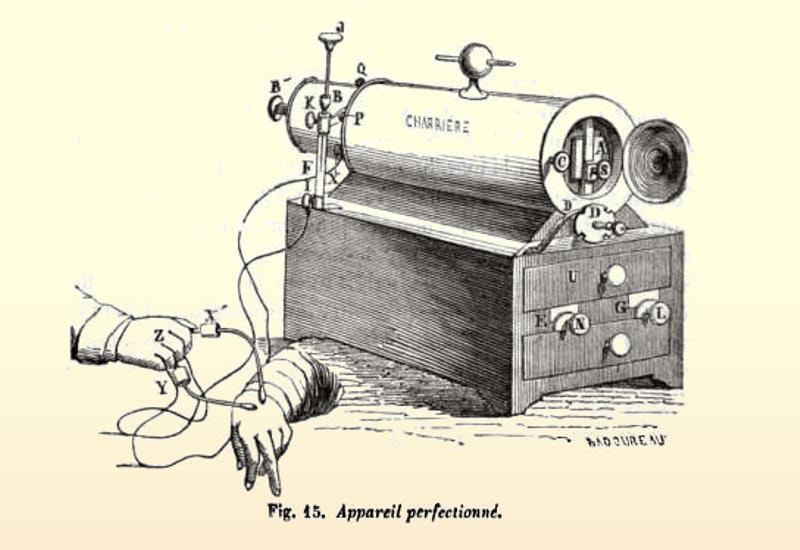
Grabado del aparato eléctrico perfeccionado por Guillaume-Benjamin Duchenne durante el primer tercio del siglo XIX. Duchenne aplica una descarga farádica través de electrodos (reóforos) sobre la superficie de los diversos músculos de la cara, lo cual originaba la contracción de los mismos, dando lugar a una variedad de expresiones. Aryse.org
Electricidad y dolor Por increíble que pueda resultar el empleo de la electricidad en los procesos dolorosos se remonta incluso antes del conocimiento del propio fenómeno, ya que era conocido el efecto y utilizado en la antigüedad. En el año 47 a.c., se cita a Scribonius Largue quien relata el caso de su artritis y la experimentación de alivio a su dolor después del contacto accidental de la zona del dolor con un pez torpedo. A partir de eso momento y con la divulgación del caso, en la antigüedad se empleó las descargas eléctricas de este pez terapias contra los dolores artráldicos y en las cefaleas. Todavía en la edad media, Avicena y Averroes continuaron recomendando su aplicación en los mismos casos., pero la verdadera experimentación con la electricidad llegó en el siglo XVIII cuando se introduce la electricidad de forma artificial por generadores electrostáticos. Tras la aparición de las botellas de Leiden se amplían las indicaciones, aunque sin progresar en resultados positivos, aunque el efecto analgésico de este tipo de estimulación recibió un amplio reconocimiento en el siglo XIX con Duchenne de Boulogne y Charle Web aplicando descargas farádicas para tratar el dolor facial atípico y la neuralgia del trigémino, pero no fue hasta la llegada de la primera mitad del siglo XX que Hermel comenzó a tratar con corriente los dolores ciáticos y las neuralgias lumbosacras .
Guillaume-Benjamin Duchenne, (a la derecha de la imagen) conocido como Duchenne de Boulogne (1806 – 1875), fue un neurólogo francés que en 1833 comenzó a experimentar con el uso terapéutico de la electricidad,se le considera como uno de los padres de la neurología moderna por sus estudios electrofisiológicos sobre el sistema nervioso y el precursor de la fotografía clínica. Hoy en día se le conoce por el diagnóstico de la miopatía, y por sus experimentos fotográficos de la década de 1850. Aryse.org
Ahora bien, realmente, como ya he comentado antes, la historia de la anestesia en el sentido estricto de la palabra, como ciencia en sí, llego realmente con los avances de la química, especialmente con el descubrimiento de algunos gases en estado puro, en Inglaterra el oxígeno en el año 1771, un año después, 1772, se descubrió el óxido nitroso o el aislamiento del dióxido de carbono en el año 1782 A partir de mediados del siglo XIX las referencias comienzan a aflorar: ya en 1842 el boticario y médico norteamericano, el doctor Crawford W. Long (1815-1878) médico rural en Jefferson (Georgia) haciendo inhalar éter a un amigo suyo quien sufría de dos tumores en la nuca, es operado exitosamente y sin dolor el 30 de marzo de 1842. Poco después ya aparecen dos grandes nombres que introducen un cambio en el rumbo de la historia de la anestesiología, los doctores Horace Wells y William Morton experimentaron con óxido nitroso el primero y cloroformo y éter el segundo. Con el paso de los años la anestesia general y las intervenciones sin dolor para el paciente se fueron sucediendo, pero también los problemas asociados a tal anestesia, la toxicidad de los productos empleados y la posibilidad de una tragedia asociada al uso de estas técnicas de sedación también se sucedían. No satisfechos con los anestésicos disponibles, muchos investigadores se dieron a la tarea de encontrar nuevas opciones como el cloruro de etilo, el etileno y otros anestésicos como el ciclopropano a comienzos de 1930 o el éter divinílico o el propiletinelo al comienzo de la década de 1940. La anestesia intravenosa progresó a su vez con el descubrimiento de los barbitúricos a principios de siglo, como el barbital, luego el fenobarbital y el tiopental sódico por ejemplo, a mediados de los años 30 del siglo pasado. Con el tiempo se desarrollaron todo tipo de sofisticadas máquinas de anestesia y procedimientos para sedar al paciente, la historia es larga e interesante, los éxitos y las tragedias se han sucedido hasta nuestros días, los riesgos de la anestesia se han ido reduciendo a medida hemos avanzado en la comprensión del sistema nervioso y el funcionamiento del ser humano en muchas facetas, pero ya desde principios del siglo XX se intentó la realización de anestesias “parciales”, de bloqueos “menores” del dolor, que en teoría supusieran un menor riesgo y complicación para el paciente hasta alcanzar métodos anestésicos que pudieran traspasar incluso las anestesias locales de carácter químico.
Los doctores Horace Wells y William Morton, pioneros de la anestesiología, Horace Wells nació en Windsor, Connecticut, e inició sus estudios de odontología en 1834, abriendo dos años más tarde su consultorio en Hartford. Por esta época conoció a su colega el doctor Morton, quien vivía y trabajaba en Farmington. Se trasladaron a Boston para trabajar conjuntamente, impulsados por la idea de buscar la manera más eficiente de eliminar el dolor a sus pacientes. Desafortunadamente no se entendieron y debieron separarse. Mientras que Wells fracasó y fue tachado de loco por sus colegas injustamente y acabando alcoholizado y adicto al éter, suicidándose el 21 de enero de 1848 en una cárcel de Nueva York, Morton se dedicó más tarde a diseñar uno de los primeros aparatos de anestesia, que consistía de una esfera de vidrio con fieltro en su interior y dos orificios: uno superior a través del cual se introducía el éter y uno inferior del cual salía la boquilla que iba a la boca del paciente. El 16 de octubre de 1846 se empleó con éxito para dormir a un paciente y extraer un enorme tumor de la glándula submaxilar sin problemas ante la gran la sorpresa de todos los asistentes al ver que el paciente no se defendió durante la cirugía y que se pudiera terminar el acto quirúrgico sin que hubiera indicios de dolor. Historia de la Anestesia. Jaime F., Martina M.
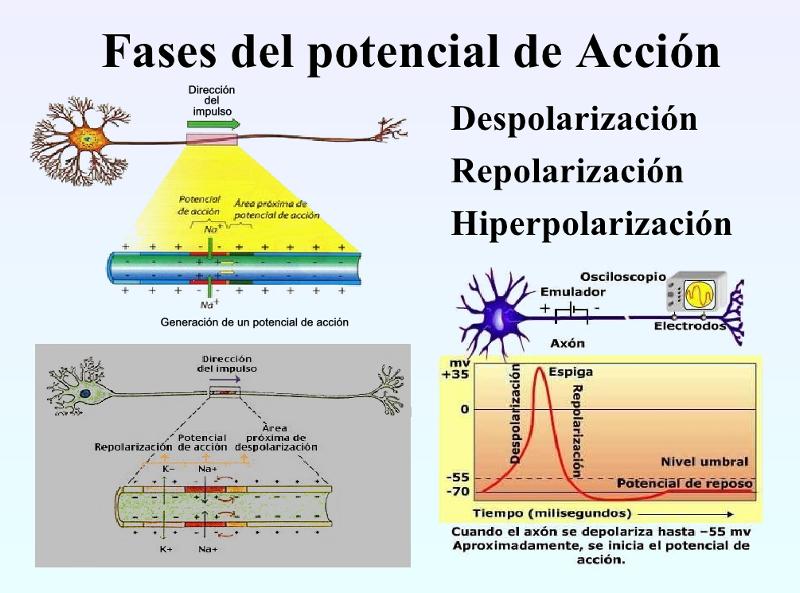
Respecto a la historia de la neuroestimulación moderna, digamos que esta comienza ya en 1891, cuando Von Helmholz, en una serie de experimentos con una preparación aislada de músculo y nervio, demostró la naturaleza temporal de la conducción de la fibra nerviosa, permitiendo los posteriores y más relevantes avances en la fisiología de la estimulación nerviosa periférica. Básicamente la conclusión de estos hallazgos se resume en que las células nerviosas tienen un voltaje de reposo de -80 mV (medido en el interior de la célula con respecto al exterior) y la capacidad de crear un potencial de acción que se propaga. Para que un estímulo nervioso se propague a lo largo del nervio, un cierto estímulo umbral (mecánico, químico o eléctrico) debe ser aplicado al nervio. Por debajo del valor umbral, ningún impulso es propagado, mientras que un aumento de la intensidad por encima de ese umbral hará que la propagación del impulso se produzca indefectiblemente. Al alcanzar el umbral se produce un cambio en la conductancia en los canales de Na-K dependientes del voltaje. (Al final del reportaje he añadido una explicación un poco más detallada para que se comprendan estos principios de las fisiología de la estimulación) Ya en 1912, Von Perthes describe por primera vez el uso de un estimulador selectivo de nervios periféricos, con una aguja aislada con níquel, pero hablamos de principios del siglo XX, las dificultades tecnológicas de la época impidieron el éxito y hubo que esperar casi medio siglo con un lento avance hasta la llegada de la microelectrónica y los primeros marcapasos, pero desde entonces el progreso ha sido imparable en la investigación sobre los procesos neurológicos y el empleo de la estimulación elécticra, el primer neuroestimulador moderno se colocó hace ya más de medio siglo y aunque era muy rudimentario, la tecnología ha avanzado de manera exponencial y se han identificado las patologías que tienen mejor indicación para este tratamiento. El implante de neuroestimuladores está demostrando cada día más seguridad y eficacia para tratar el dolor crónico y se ha convertido además en un tratamiento con un coste inferior al tradicional para algunas enfermedades, como el síndrome de cirugía fallida, el síndrome de dolor regional complejo, la patología arterial periférica o la angina pectoris refractaria. Los avances en biotecnología y neurociencia son cada vez más importantes, permitiendo que cada vez más patologías con un fuerte componente de dolor puedan ser tratadas a través de la neuroestimulación: pacientes que han sido intervenidos en la columna y que luego empeoraron, patologías obstructivas de las arterias, donde la neuromodulación no sólo disminuye el dolor, sino que también mejora la circulación sanguínea o hasta el dolor neuropático, por ejemplo, después de la amputación de un miembro o de un accidente cerebro vascular.
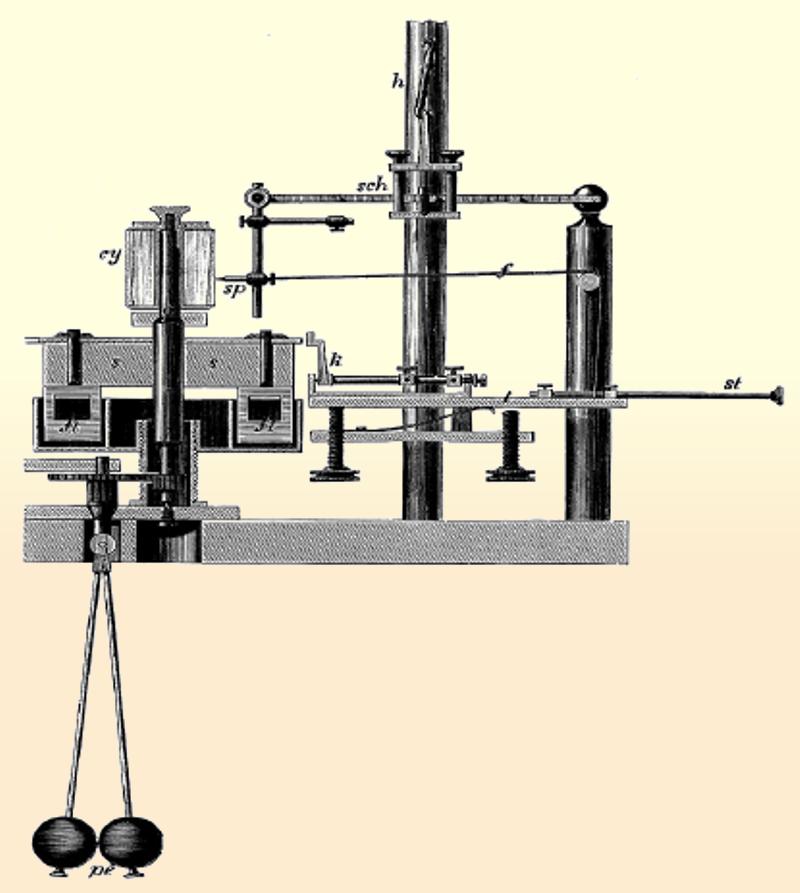
Miógrafo de Hermann von Helmholtz (1891) para la determinación experimental de la conducción del dolor y la medida del tiempo de reacción del sistema nervioso. Para sus experimentos Helmohltz experimentó con ranas y humanos, estimulando primero el nervio cerca del músculo y luego alejándose progresivamente, inicialmente calculó que la velocidad de respuesta era aproximadamente una décima parte la velocidad del sonido, en torno a unos 26 m/s, para posteriormente llegar a unos 50 m/s. Research Gate
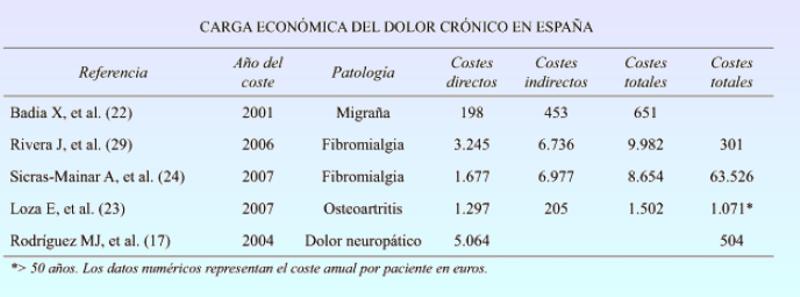
El creciente número de patologías que provocan dolor crónico y pueden ser tratadas con estos dispositivos resulta un detalle muy importante, pues no solo hablaríamos de ventajas para el paciente, sino también para un sistema sanitario con profundos problemas económicos y asistenciales que debe hacer frente al desafío futuro maximizando la eficacia de los recursos a su disposición ya que la reducción a medio plazo de los costes en fármacos para paliar el dolor y otras complicaciones secundarias suprimidas beneficia también al resto de los pacientes al dejar más recurso disponibles para ellos. No olvidemos que se calcula que unos 1.500 millones de personas padecen de dolor crónico en el mundo, y entre el 3 y el 4,5 % de la población mundial sufre de dolor neuropático. Por tanto las mejoras en tecnología sanitaria e investigación son un imperativo si permiten una mejor calidad de vida a los pacientes y la liberación de tremendos recursos económicos que redunden en el beneficio de la asistencia a terceros.
Aunque el coste del dolor crónico es difícil de calcular, ya que no se dispone de datos globales, se cree que cuesta a Europa más de 300 billones de euros (20) o en torno al 1,5-3 % del PIB (4,21). En España se estima que el coste total (directo e indirecto) que ocasiona el dolor crónico sería de 16.000 millones de euros anuales, lo que supone el 2,5 % del PIB. Estas cifras deben mirarse, en todo caso, con cautela, ya que en nuestro país tampoco existen estudios globales que lo avalen. En cambio, sí se han valorado en cambio los costes por dolor de diferentes patologías (En la imagen). En España, sólo la migraña supone una carga económica de 1.076 millones de euros anuales, en su mayoría (68 %) debido a costes indirectos (732 millones de €) (22). Se estima que la osteoartritis de rodilla y cadera supone un coste anual de 4.738 millones de euros (23) (equivalente al 0,5 % del PIB). Expertos del Pain Proposal consideran que no se están empleando eficazmente los recursos que disponemos para tratar el dolor crónico. Un mejor uso de los mismos permitiría ahorrar dinero al sistema sanitario. Desde el punto de vista económico, el dolor crónico genera gastos debidos a la atención sanitaria y a pérdidas potenciales de producción. Estas últimas se ven agravadas cuando se demora o no llega a tener lugar una atención adecuada. Revista de la Sociedad Española del Dolor, Situación actual del dolor crónico en España: iniciativa "Pain Proposal"
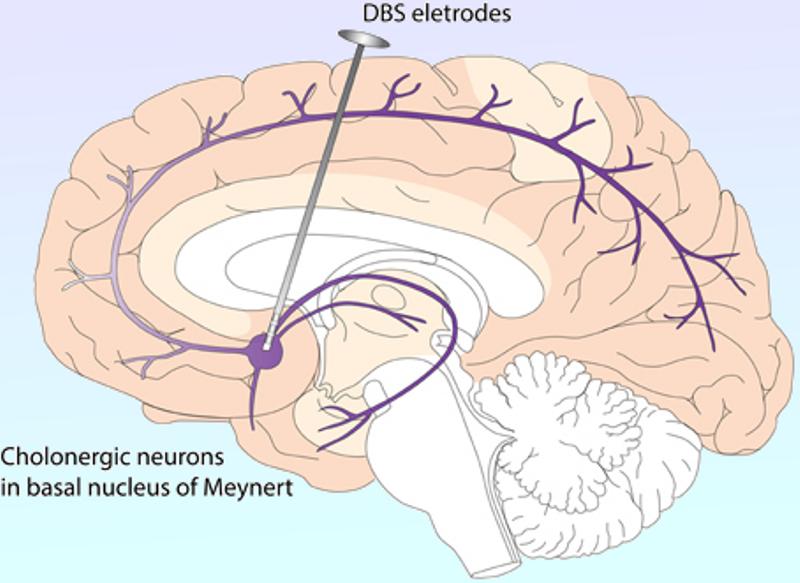
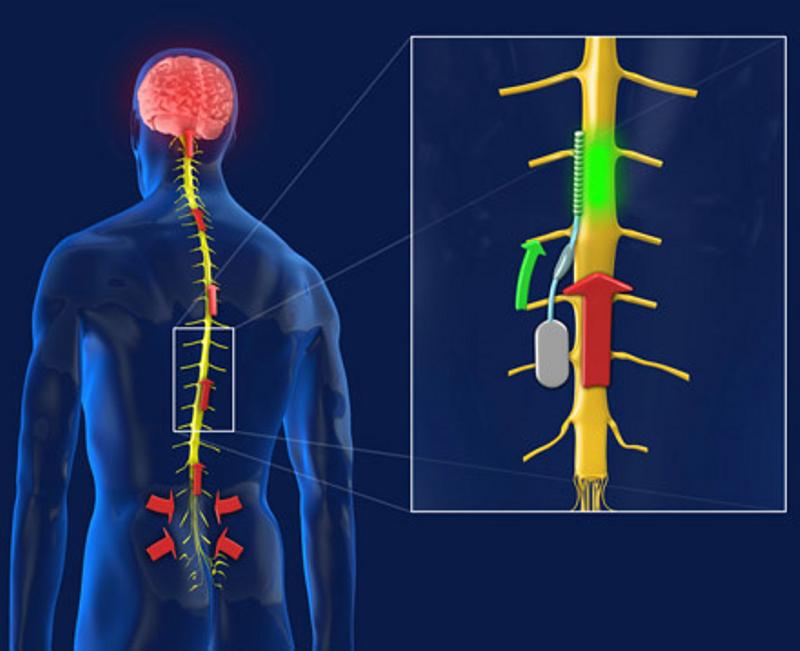
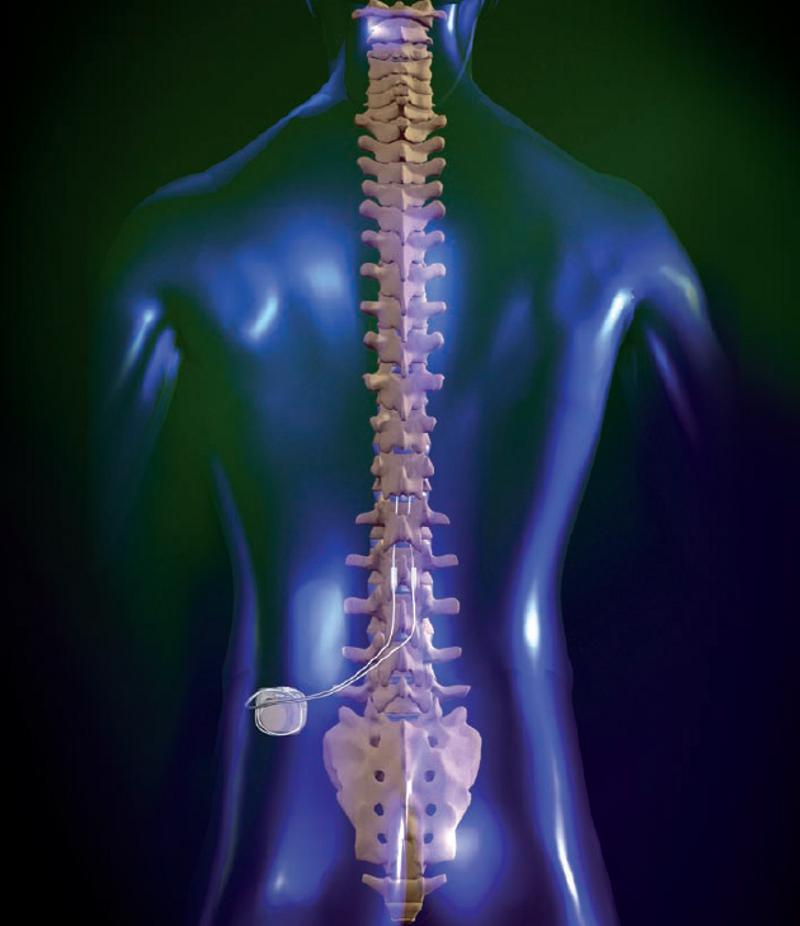
Adentrándonos en los “bloqueos” y la neuromodulación medular. A día de hoy la neuroestimulación contra el dolor consiste en el implante quirúrgico de un dispositivo similar a un marcapasos o incluso más pequeño debajo de la piel, en la pared abdominal o la zona glútea por ejemplo, dependiendo de las condiciones del paciente y donde se conecte el neuroestimulador, este se conecta a electrodos colocados por ejemplo en el espacio epidural, ahora bien según la zona donde deseemos realizar el bloqueo estos electrodos podrán colocarse en una u otra zona de nuestra red nerviosa espinal o incluso en alguna zona del cerebro, en el caso de ciertas enfermedades donde pueden resultar útiles, por ejemplo, en la estimulación cerebral profunda un procedimiento quirúrgico usado para tratar una variedad de síntomas neurológicos invalidantes, como los síntomas debilitantes de la enfermedad de Parkinson, es decir el temblor, la rigidez, el agarrotamiento, el movimiento lento o los problemas para caminar. También se puede emplear en las zonas superiores para tratar el temblor esencial, un trastorno neurológico común del movimiento, es decir se intenta emplear el procedimiento en pacientes cuyos síntomas no pueden ser controlados adecuadamente con medicamentos.
Esquema con la colocación de los electrodos en Estimulación cerebral profunda (DBS) Zhang Q, Kim Y-C, Narayanan
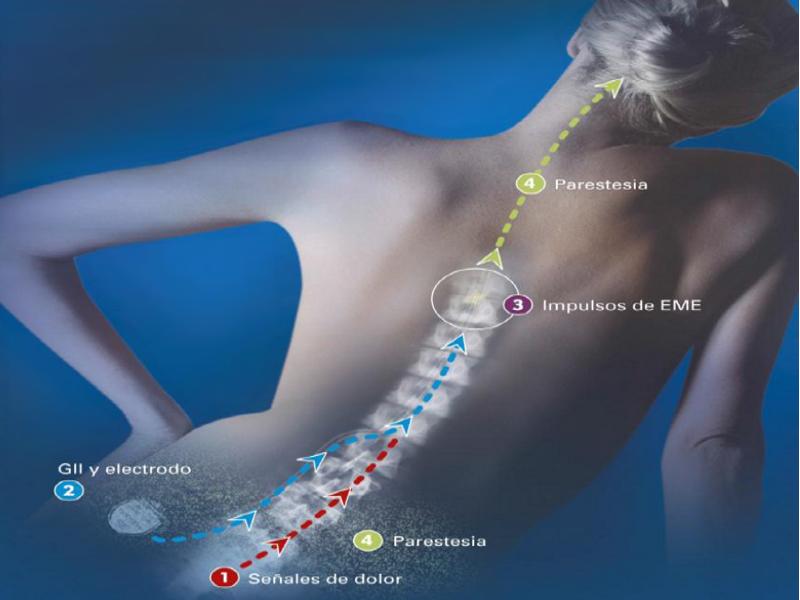
Las señales eléctricas transmitidas por el neuroestimulador hacia la médula causan un bloqueo u hormigueo en el área afectada por el dolor e inhiben a las neuronas ligadas a la percepción de éste. Además, el paciente cuenta con un dispositivo con el cual puede programar la estimulación dentro de ciertos parámetros establecidos por el médico y que previamente le habrán explicado para un correcto funcionamiento. En el caso por ejemplo de la estimulación cerebral el objetivo del neuroestimulador consiste en enviar estimulación eléctrica a áreas específicas del cerebro que controlan el movimiento, bloqueando las señales nerviosas anormales que causan el temblor y los síntomas de la enfermedad de Parkinson. Este dispositivo es realmente muy similar al que describimos para enfrentarnos contra el dolor crónico, consta de tres componentes: el electrodo, la extensión y el neuroestimulador. El electrodo, un cable delgado y aislado, se inserta a través de una pequeña abertura en el cráneo y se implanta en el cerebro, posicionando la punta dentro del área objetivo de la estimulación dentro del cerebro. La extensión es un cable aislado que se hace pasar bajo la piel de la cabeza, el cuello y el hombro, conectando el electrodo al dispositivo neuroestimulador propiamente dicho, el cual contiene la batería encargada de dar la energía al dispositivo que suele implantarse en este caso bajo la piel cerca de la clavícula, aunque como ya hemos dicho, dependiendo del paciente el lugar puede variar y en algunos casos puede implantarse más abajo en el pecho o bajo la piel sobre el abdomen.
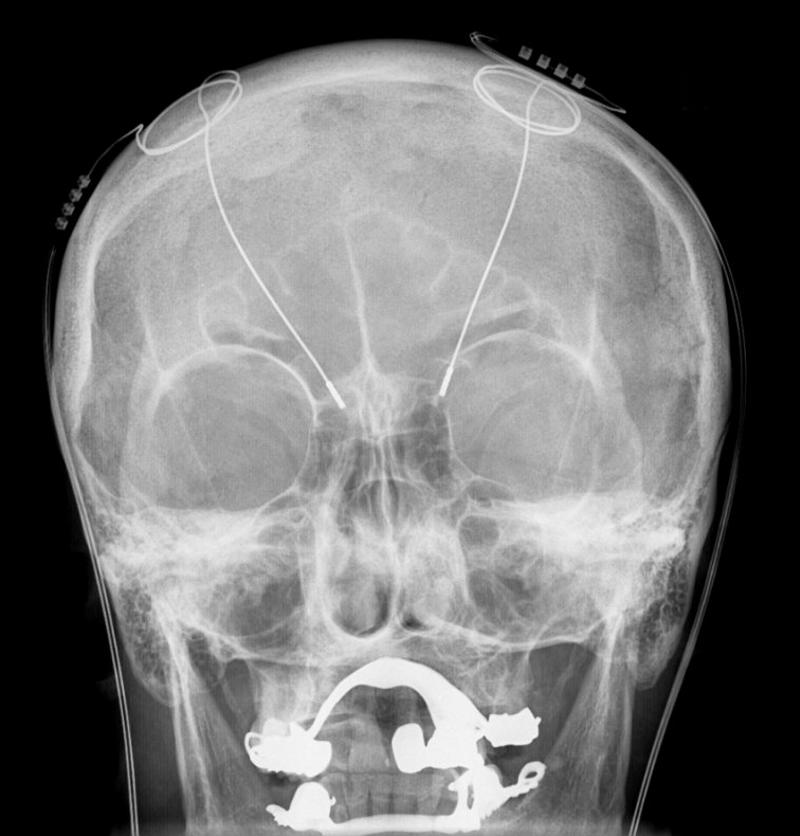
Imagen de rayos X del cráneo de un paciente con un Estimulador Neuronal Profundo implantado (Atención: Las zonas en blanco en el maxilar y la mandíbula corresponden a prótesis metálicas dentales que no guardan relación). Hellerhoff
Una vez que el sistema esté colocado, igual que en el resto de neuroestimuladores se envían impulsos eléctricos desde el dispositivo hacia el cable de extensión y el electrodo dentro del cerebro, interfiriendo y bloqueando las señales eléctricas que causan los síntomas de Parkinson. En definitiva el planteamiento y funcionamiento de un neuroestimulador es más o menos el mismo se implante donde se implante, bloquear el dolor o cualquier señal perjudicial que pueda padecer nuestro cerebro, pero a diferencia de cirugías anteriores a estos procedimientos, correctamente realizado no daña el tejido cerebral sano o espinal, ni causa daños a las células nerviosas. Estos procedimientos bloquean las señales eléctricas de áreas específicas, pero si en el futuro se desarrollaran nuevos tratamientos más prometedores y efectivos los procedimientos de estimulación pueden revertirse, además de ajustarse fácilmente sin cirugías si cambia el estado del paciente, es decir alterando la programación.
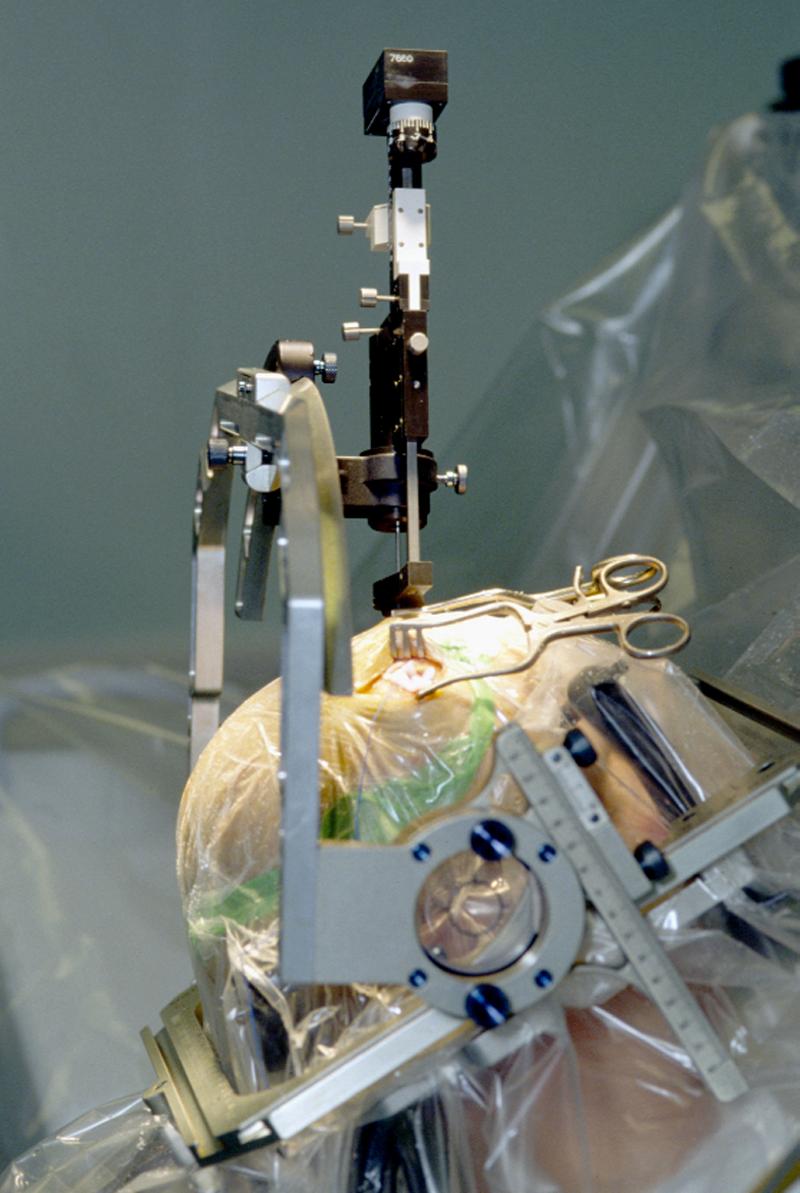
Inserción de un electrodo durante una intervención en un paciente con Parkinson para estimulación neuronal profunda (DBS) GNU/GFDL
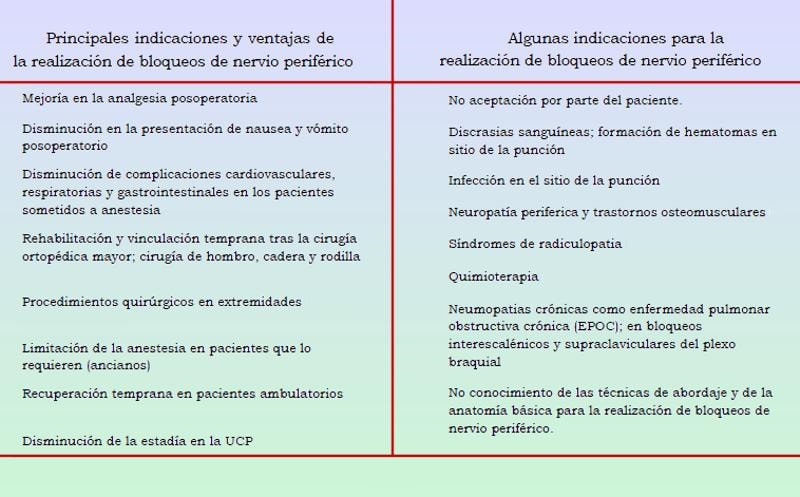
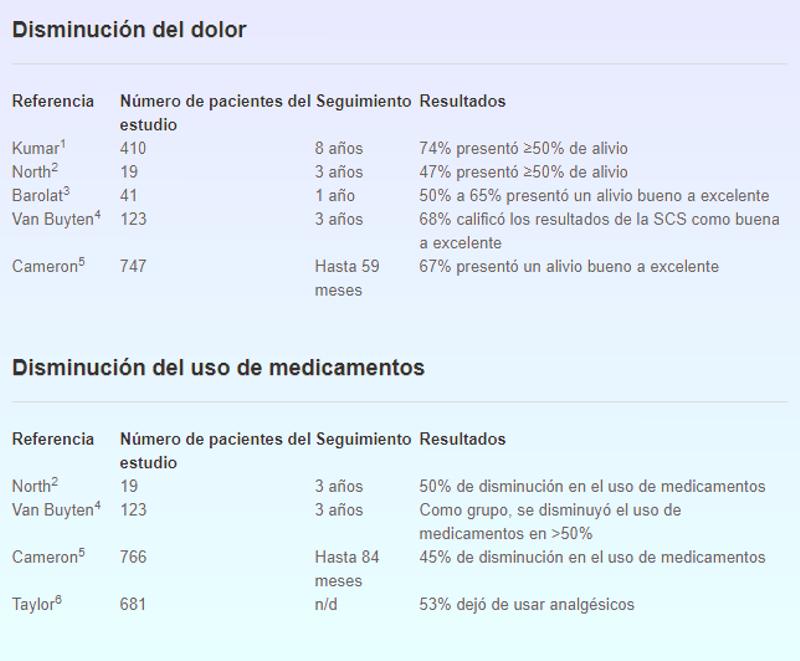
A día de hoy la neuroestimulación ha demostrado eficacia en el dolor de espalda y piernas, principalmente, en pacientes sometidos a múltiples cirugías de columna, en el dolor neuropático, por ejemplo de origen diabético o en el dolor producido por trastornos severos de la circulación sanguínea ofreciendo ya más de un 50% de disminución en el dolor y menos necesidad de tomar medicamentos analgésicos, así como una mejora en la calidad de vida, tanto a nivel funcional, social o el estado emocional, mejorando las evidencias en los implantes tempranos. Usos de la neuroestimulación que ayudan a comprender estos dispositivos: anestesia regional, bloqueos del nervio periférico y localización de los nervios, una larga historia Los bloqueos pese a lo que podamos pensar comenzaron a desarrollarse muy pronto en la historia de la anestesia. Ya en la década de 1880, los doctores William Halsted y Hall inyectaron cocaína en pacientes (en 1884 Halsted bloqueó el plexo braquial con una solución de cocaína aplicada a nivel del cuello) consiguiendo con el tiempo un bloqueo sensitivo en diversas zonas región cubital, músculo cutáneo, supratroqueal e infraorbital, demostrando desde muy temprano la efectividad de la anestesia localizada para afrontar intervenciones quirúrgicas con éxito. Tan solo cinco años después el doctor James Leonard recomendó el uso de un torniquete periférico con el objeto de reducir la circulación y así conseguir prolongar la acción de la cocaína. Poco después en el año 1903 Braun agregó epinefrina al anestésico local, con el objeto también de prolongar el efecto, llamándolo “torniquete químico”.
El Dr. Karl Koller en 1884, a la edad de 27 años. Koller, colega de Freud y pasante de oftalmología en el Hospital General de Viena, fue el primero en escribir sobre las propiedades anestésicas de la cocaína. Poco después, la cocaína llegó a los titulares y los médicos de todo el planeta acogieron con entusiasmo la nueva “droga milagrosa”. Freud claro, estaba menos feliz de que Koller le “robara” el centro de atención. University of Michigan Center for the History of Medicine
Los bloqueos periféricos continuaron su andadura en paralelo al resto de procedimientos anestésicos, ya en 1914 se introdujo el término conducción en anestesia para hacer referencia a la conducción nerviosa y se describieron por primera vez los principios de la neuroestimulación. La introducción de la aguja de trócar (Lafargue), el diseño de la jeringa de cristal por Charles G. Pravaz en 1851 y su posterior perfeccionamiento por Alexander Wood en 1855, sumado al aislamiento y demostración de las propiedades anestésicas de la cocaína por Carl Koller en 1884, fueron los acontecimientos definitivos que contribuyeron al descubrimiento y desarrollo posterior de las anestesias conductivas. Los bloqueos periféricos continuaron su andadura en paralelo al resto de procedimientos anestésicos y ya en 1914 se introdujo como acabo de mencionar el término conducción en anestesia para hacer referencia a la conducción nerviosa y se describieron por primera vez los principios de la neuroestimulación. Poco después el doctor Gaston Labat, en el año 1920, publicó el libro “Anestesia regional, técnica y aplicación” donde ya describía técnicas anestésicas y diferentes caminos para la realización de bloqueos de nervio periférico.
El doctor William Halsted en la sala de operaciones del Hospital Johns Hopkins, alrededor de 1905. Halsted usó su propio cuerpo para estudiar los efectos de la cocaína, inyectándose la droga en su brazo y ocasionalmente aspirándolo para combatir la fatiga. Él y sus colegas tomaban cocaína para aguantar el ritmo de trabajo y la presión, pero pronto se convirtieron en adictos de pleno derecho, inyectándose exclusivamente la droga por necesidad. Alan Mason Chesney Archives of the Johns Hopkins Medical Institutions
Buscando, buscando… Uno de los grandes problemas para realizar un bloqueo nervioso desde el principio de esta disciplina ha sido la búsqueda precisa de las estructuras nerviosas a tratar, con el paso de los años y el desarrollo de la tecnología se han desarrollado dispositivos para orientar al anestesista y que aumentan el porcentaje de éxito y efectividad de la anestesia, pero ante todo es de primordial importancia el conocimiento de la anatomía de la columna vertebral y de sus relaciones para poder tener una idea de los sitios que debe atravesar la aguja al abordar su misión bien en el espacio epidural o el espacio subaracnoideo y comprender todas las complicaciones asociadas. La localización de los troncos a bloquear puede ser guiada por ejemplo por un neuroestimulador de nervio periférico o bien otros medios como por guía ultrasonográfica, técnicas que reducen también el volumen y requerimientos de anestesia local o mejoran el porcentaje de éxito y eficacia de los bloqueos. Los bloqueos de nervio periférico consisten en administrar un anestésico local cerca de un nervio o tronco nervioso periférico, que como ya explicamos en las anteriores partes inhibe el potencial de acción transmembrana excitatorio, que transmite un estímulo nociceptivo por las diferentes fibras nerviosas, hacia el sistema nervioso central, lo cual modula la percepción del dolor.
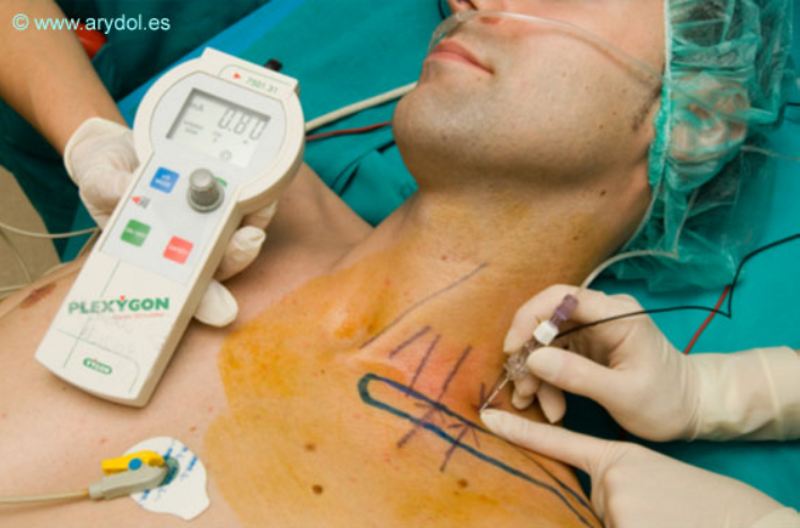
Bloqueo nervioso a nivel supraclavicular (imagen superior) utilizando una técnica de bloqueo por neuroestimulación, para ello se emplea un estimulador de nervio periférico y electrodo de superficie, una agua aislada para neuroestimulación de 50mm, mas las correspondientes agujas de infiltración local y jeringas para los anestésicos locales. Arydol
Si bien también son llamados “neuroestimuladores”, puesto que su funcionamiento es similar y sus objetivos están encaminados en la misma dirección que los explicados en este reportaje, es muy importante mencionarlos para que las personas menos iniciadas puedan diferenciarlos y mejorar el conocimiento global de su funcionamiento, pues sus principios al fin y al cabo son los mismos. Así pues el estimulador de nervio periférico es un dispositivo tecnológico utilizado para la localización de nervios periféricos, desatando la despolarización de una fibra nerviosa que conduce un potencial de acción transmembrana (PAT). Este neuroestimulador aplica un flujo de corriente externa negativo en relación con el PAT en reposo axonal que provoca una respuesta motora, mediada por estimulación de un grupo muscular inervado por los nervios a bloquear. ¿Esto qué quiere decir? Básicamente este dispositivo actúa ni más, ni menos como un “chivato”, de manera muy similar, salvando las distancias, a los primerizos experimentos de Luigi Galvani, ayudando al profesional a encontrar el punto más adecuado para la aplicación de las medidas anestésicas a través de la observación de la respuesta del musculo a un estímulo. Para que esto suceda la aplicación de un flujo de corriente eléctrica externa requiere una intensidad y duración específicas, que dependen del tipo de fibra nerviosa a tratar, así con la ayuda del dispositivo el anestesista identifica la cercanía a la fibra, al aplicar corriente eléctrica que ingresa por una aguja que se encuentra conectada a un electrodo.
Anshy Slideshare
Dada la diversa morfología de los nervios existen diferentes agujas para el neuroestimulador en diferentes tamaños y deben utilizarse de acuerdo con el bloqueo concreto a realizar, además actualmente para aumentar su efectividad se recomienda exhaustivamente el uso de agujas cubiertas con materiales aislantes muy específicos como teflón en las zonas donde el contacto excesivo es innecesario y puede resultar incluso un problema. En este caso la función de estos dispositivos consiste en la realización de una anestesia o analgesia local que requiere de la inyección de anestésicos locales u otros fármacos lo más cercanos a la localización de los nervios correspondientes que deseamos bloquear. Para ello es fundamental que el especialista tenga un perfecto conocimiento de la anatomía, puesto que el neuroestimulador tan solo le va a servir de ayuda para precisar las referencias anatómicas adecuadas y esto es un punto extrapolable a cualquiera de los diferentes dispositivos de este tipo sea cual sea su función para detectar nervios o bloquear el dolor, la efectividad en todos los casos dependerá entre otros factores del perfecto conocimiento anatómico y del procedimiento a seguir por el profesional que realice la intervención así como la decisión adecuada en la selección de los electrodos a conectar.
Fuente: Félix Arturo Salazar Pérez, Geovanny Rodríguez Sánchez, Rev. Col. Anest. Agosto - octubre 2011. Vol. 39 - No. 3: 387-402
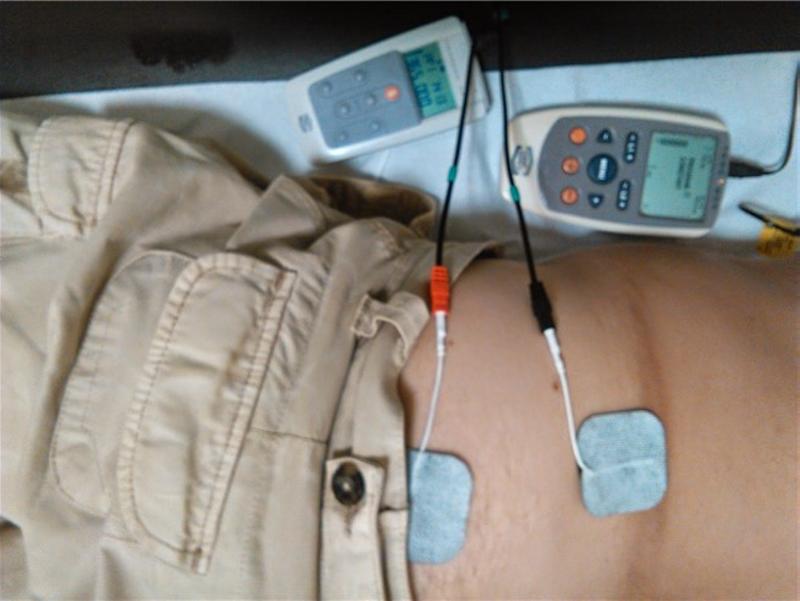
Estimulación nerviosa eléctrica transcutánea (TENS)… casi, casi A veces se confunde también esta técnica empleada para el tratamiento del dolor agudo y crónico con el tema que nos ocupa, ciertamente sigue principios similares e igualmente se emplea para tratar el dolor, tanto agudo cómo crónico en combinación con otras modalidades terapéuticas, aunque también puede ser empleada en otras afecciones no dolorosas. De forma sencilla podríamos definir el TENS como la actividad eléctrica pulsátil con una corriente de baja frecuencia sobre la piel de una zona dolorosa que activa las fibras aferentes largas que estimulan a su vez las neuronas inhibitorias del asta dorsal, liberando endorfinas, cambiando en el paciente la percepción corporal del dolor. Puede ser un tratamiento coadyuvante eficaz en diversos dolores crónicos o en ciertos casos en los agudos, así que sus efectos pueden reducir también la ansiedad y mejorar la capacidad de descanso del paciente. Las formas ordinarias de ondas de los equipos son: rectangulares o en espiga; monofásicas o bifásicas. Por lo general no se emplea la corriente continua pues al transportar iones a la piel, causan irritación cutánea y descomposición de los electrodos, lo que se evita con la corriente alterna en la que los iones fluyen primero en una dirección y luego en la opuesta. Pueden emplearse electrodos desechables o no desechables (caucho de silicona carbonizada) y en este caso se emplea un gel hidrófilo para facilitar el paso de la corriente. (¡Tranquilos!, luego trataremos un poco la cuestión de las cualidades eléctricas de todos estos dispositivos)
Una unidad TENS envíando impulsos eléctricos a través de la piel. Estos pulsos alteran las señales de dolor en el cuerpo, creando un alivio temporal o permanente del dolor. Pueden controlar nervios anormalmente excitados y liberar endorfinas. En la imagen se observa el dispositivo actuando sobre la región lumbar. En ocasiones, una corriente eléctrica puede ser demasiado intensa para un paciente, causando ardor o irritación en la piel. El efecto de TENS en los fetos se desconoce en este momento. Las mujeres embarazadas no deben usar estimulación eléctrica para aliviar el dolor. Las personas con enfermedades del corazón también deben tener precaución. Algunas personas con alergias en la piel pueden reaccionar a las almohadillas de electrodos que se usan con las unidades. Las personas con marcapasos, bombas de infusión, desfibriladores o dispositivos similares no deben exponerse a las corrientes eléctricas producidas por una unidad TENS. Medic-Life
En TENS principalmente se emplea una de baja frecuencia de 1 a 4 Hz y de alta intensidad que es la que causa la contracción muscular visible y otra de alta frecuencia de 50 a 120 Hz y baja intensidad que causa una sensación de zumbido. La estimulación de alta frecuencia y baja intensidad parece que actuaría de forma gráfica: “cerrando la puerta”. (Recordemos la vieja teoría de la puerta - gate control- realizada por Melzack y que explicamos en la primera parte) donde nos proponía que cuando las fibras largas A son estimuladas, el impulso nociceptivo de fibras A y C es inhibido en la interneurona de la sustancia gelatinosa del asta dorsal bloqueando el impulso doloroso. Por otro lado la corriente de baja frecuencia y alta intensidad actúa tanto en fibras de grueso o de fino calibre, dependiendo de los mecanismos supraespinales descendentes inhibitorios para poder actuar. La realidad es que a mayo del 2018 cuando se escribe este reportaje los profesionales no se ponen completamente de acuerdo sobre el uso de TENS para el manejo del dolor, lo máximo que podemos decir es que parece ser que son necesarios más estudios con metodología adecuada para dilucidar su eficacia no solo en el campo del dolor crónico sino también en el del agudo. Mecanismos de acción de la estimulación de la médula espinal ( EME) Una vez que hemos intentado desenredar las distintas variantes volvamos por fin al campo que nos interesa, como ya hemos explicado en los anteriores reportajes, a finales de los años 60 la teoría de la compuerta proporcionó una explicación para entender el mecanismo de acción medular en la percepción del dolor, pero investigaciones posteriores no lograban explicar más a fondo el problema y ser concluyente, ¿cómo la estimulación medular ejercía su efecto en el alivio del dolor?. Por lo cual se hizo evidente un aspecto de la neuroestimulación medular, donde el efecto sobre el dolor nociceptivo parecía ser muy limitado. Esto podría relacionarse con el hecho de que incluso en el mejor de los casos seleccionados, había un porcentaje relativamente alto de pacientes, que podría alcanzar el 25-50% donde no conseguían alivio del dolor con esta técnica. Los intentos de identificar clínicamente el éxito eran difíciles. Hasta llegar hace unos pocos años al trabajo del grupo de Karolinska quienes demostraron con varios estudios en ratas que el efecto de la neuroestimulación medular puede estar relacionado con la liberación de neurotransmisores inhibidores en el asta dorsal, especialmente ácido aminobutírico (GABA) la acetilcolina y la serotonina. La participación del sistema GABA parece estar apoyada por un pequeño ensayo aleatorizado reciente que utilizó con éxito, el tratamiento intratecal, con el agonista GABA, baclofeno como adyuvante en la neuroestimulación medular, fue positivo. En otro estudio reciente con ratas en el Hospital Johns Hopkins, también se ha sugerido que el efecto de la neuroestimulación medular en parte está relacionada con la activación de tanto tractos de fibras del sistema ascendente como descendente en la médula espinal, produciendo atenuación de la hiperexcitabilidad en las fibras de amplio rango dinámico (WDR) en el asta dorsal.
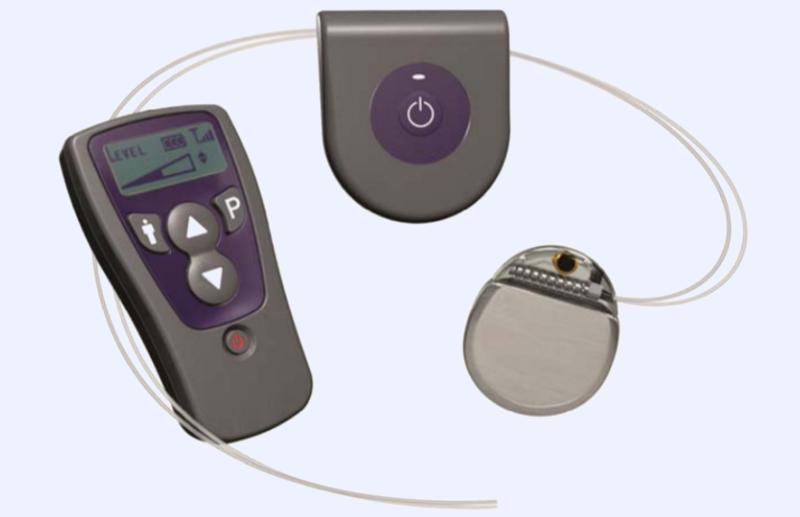
En la imagen neuroestimulador actual para el tratamiento de estimulación de la médula espinal (EME) de izquierda a derecha, los componentes de los que contas: el sistema para la estimulación de la médula consta de un control remoto, un cargador y un generador de pulsos implantable (GII). Boston Scientific
Avanzan los años, avanza la tecnología… A principios de los años 70 el neurocirujano estadounidense C. Norman Shealy publicó un el caso de un paciente de 70 años de edad, quien sufría dolor intratable relacionado con un carcinoma bronquial. Shealy propuso, que en lugar de estimular el nervio periférico directamente, podría ser más eficaz estimular la médula espinal donde la mayoría de los impulsos propioceptivos, pero la decisión de Shealy para colocar el electrodo subduralmente, dio lugar a un número importante de complicaciones. Además, genero muchas dudas sobre los criterios de selección de los pacientes que se podrían beneficiar de estos tratamiento, siendo posteriormente, elegidos muy vagamente, lo que llevo por desgracia a un gran número de tratamientos fracasados, que por fortuna se han resuelto con los nuevos protocolos de selección una vez hemos podido comprender mejor todos los complejos mecanismos involucrados. Pero en aquella época, los pobres resultados y múltiples complicaciones, desalentaron la implantación de estos dispositivos y el propio Shealy implantó un dispositivo a su último paciente en 1973. A pesar del desinterés médico y la pobre tecnología de la época, los avances continuaron y en paralelo con el avance de la electrónica y la miniaturización se fueron realizando equipos de mayor calidad y sofisticación. En esta búsqueda de técnicas más seguras, se intentó la colocación del electrodo en el espacio epidural, reduciendo drásticamente la tasa de complicaciones neurológicas y facilitando enormemente la colocación de los dispositivos, llevando al desarrollo de la técnica de implantación percutánea, permitiendo que no solo neurocirujanos sino principalmente también anestesiólogos pudieran realizar este procedimiento con fiabilidad y precisión cada vez mayor.
El neurocirujano estadounidense C. Norman Shealy es pionero en la medicina del dolor. Se le atribuye la invención del estimulador nervioso eléctrico transcutáneo, el estimulador de la médula espinal y la ablación por radiofrecuencia para el dolor de espalda que surge de la artropatía facetaria. Curiosamente, a modo de apunte diremos que en la actualidad Shealy ha devenido en un controvertido comunicador de técnicas para la vida sana, con planteamientos médicos y en neurociencia que algunos consideran en e límite con la pseudociencia, contando con fervientes defensores y detractores. Normshealy bio
A partir del año 1972 el equipo del doctor Hosobuchi incorpora el uso de electrodos percutáneos flexibles que se introducen en el espacio extradural, relanzando esta técnica, al resultar más cómoda para el paciente, permite la predicción del resultado sin necesidad de otra intervención quirúrgica y evitar las complicaciones con técnicas intradurales. La carrera así continua y el equipo de Urban y Nashold en el 1978 presentan la primera serie amplia de casos con dolor crónico tratados por este método. Concluyendo que la incidencia de efectos secundarios es prácticamente nula y que el porcentaje de resultados excelentes era alto. Tras el éxito inicial trataron multitud de procesos dolorosos de diversa etiología como son las distrofias simpáticas reflejas, dolor postamputación, araconiditis, avulsiones de plexo braquial, cáncer, causallgias, coccigodinia, neuropatía diabética, lumbalgias, esclerosis múltiples, avulsión radicular, paraplejia, miembro fantasma doloroso, traumatismos, raquialgias, tabes dorsal y disesteias postcordotomia. Sin embargo, los fracasos en el control del dolor en algunos de los casos les forzaron a concretar las indicaciones, pero por otro lado la aceptación de la teoría de los modelos funcionales inhibitorios del dolor, el avance en la tecnología y los buenos resultados obtenidos mediante las técnicas descritas posibilitaron el desarrollo de otros métodos de neuroestimulación, sobre todo a nivel central, para el tratamiento del dolor, concrétamente la estimulación de la sustancia gris periacueductal y periventricular y del complejo ventral posterior talámico.
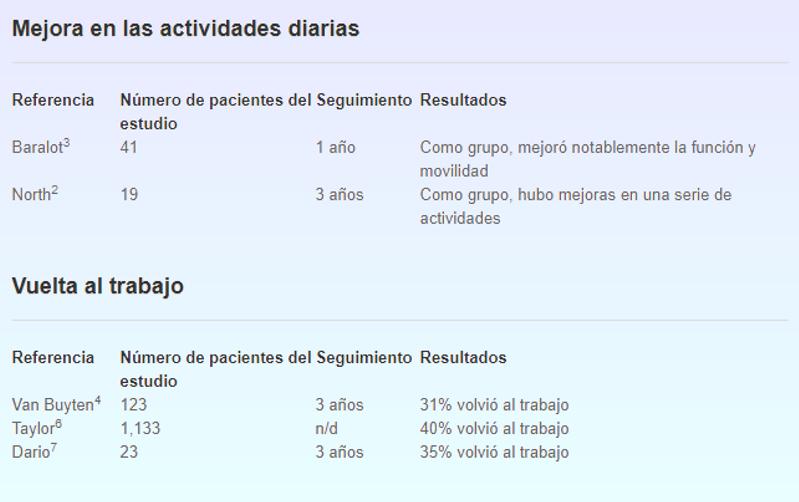
A mediados de la pasada década el seguimiento de pacientes que habían sido tratados con estimulación de la médula espinal confirmaron la eficacia del tratamiento para reducir el dolor y aumentar su calidad de vida significativamente, incluyendo la reincorporación al trabajo entre otras actividades.
1 Kumar K, Hunter G, Demeria D. Spinal cord stimulation in treatment of chronic benign pain: challenges in treatment planning and present status, a 22-year experience. Neurosurgery. 2006;58(3):481-496. 2 North RB, Kidd DH, Farrokhi F, Piantadosi SA. Spinal cord stimulation versus repeated lumbosacral spine surgery for chronic pain: a randomized, controlled trial. Neurosurgery. 2005;56(1):98-107. 3 Barolat G, Oakley JC, Law JD, North RB, Ketcik B, Sharan A. Epidural spinal cord stimulation with a multiple electrode paddle lead is effective in treating intractable low back pain. Neuromodulation. 2001;4(2):59-66. 4 Van Buyten JP,Van Zundert J,Vueghs P,Vanduffel L. Efficacy of spinal cord stimulation: 10 years of experience in a pain centre in Belgium. Eur J Pain. 2001;5(3 Suppl Spine):299-307. 5 Cameron T., Safety and efficacy of spinal cord stimulation for the treatment of chronic pain: a 20-year literature review. J Neurosurg. March 2004;100(3):254-267. 6 Taylor RS,Van Buyten JP, Buchser E. Spinal cord stimulation for chronic back and leg pain and failed back surgery syndrome: a systematic review and analysis of prognostic factors. Spine. 2005;30(1):152-160. 7 Dario A, Fortini G, Bertollo D, Bacuzzi A, Grizzetti C, Cuffari S.Treatment of failed back surgery syndrome. Neuromodulation. 2001;4(3):105-110. En paralelo otro de los factores evolutivos que contribuyeron al desarrollo de la neuroestimulación y a la confirmación de la existencia de los mecanismos inhibidores de la transmisión nociceptiva fue el descubrimiento de los mecanismos bioquímicos íntimos que influían en ella que anteriormente ya hemos comentado. En función del mayor conocimiento de los mecanismos de acción de la neuroestimulación y de los resultados satisfactorios que ofrecían en el campo del tratamiento del dolor, sus diversas modalidades técnicas fueron aplicándose a otras indicaciones, cobrando popularidad y siguiendo su desarrollo hasta el día de hoy. ¡Listos para implantar! Así que por suerte, tras esta larga evolución la neuroestimulación medular ya se utiliza para tratar una amplia gama de condiciones dolorosas, aunque lamentablemente reconozcámoslo todavía existe una relativa ausencia de ensayos controlados que evalúen todo el espectro de indicaciones actuales, aunque cada día este problema se va solucionando a medida que los profesionales van comprendiendo mejor los mecanismos del dolor y las enfermedades que hasta hace poco eran profundamente incomprendidas como pudiera ser el caso de la mencionada SDRC y donde ya son comunes como en el dolor por angina, el dolor postoperatorio persistente de cirugía de columna, el tratamiento de estimulación medular en la enfermedad vascular periférica o la angina, donde como ya hemos comentado la evidencia actual indica que además del efecto puramente analgésico apunta a una mejoría en la condición isquémica. Con el tiempo otras condiciones se han ido sumando: dolor debido a la lesión del nervio periférico, dolor por enfermedad vascular periférica y neuropatía diabética, dolor del miembro fantasma, neuralgia post-herpética, dolor visceral crónico o el dolor por trauma medular, aunque solo ahora con el avance tecnológico estas condiciones poco a poco van obteniendo mejores resultados a medida se comprende mejor los mecanismos del dolor en ellas y se mejoran las prestaciones de los nuevos dispositivos o los protocolos de intervención.
En la imagen ejemplos de la gama de neuroestimuladores de la empresa Medtronic, diseñado para pacientes con diferentes requerimientos de energía para el tratamiento del dolor (≤ 4,0 V) (≥ 4,0 V) (≥ 7,0 V) o sin batería recargable (cada vez menos recomendados en ciertos casos por sus limitaciones). En la imagen inferior vemos en detalle un moderno programador diseñados para regular los dispositivos con facilidad por parte del paciente y diversos electrodo tanto percutáneos como quirúrgicos. Medtronic
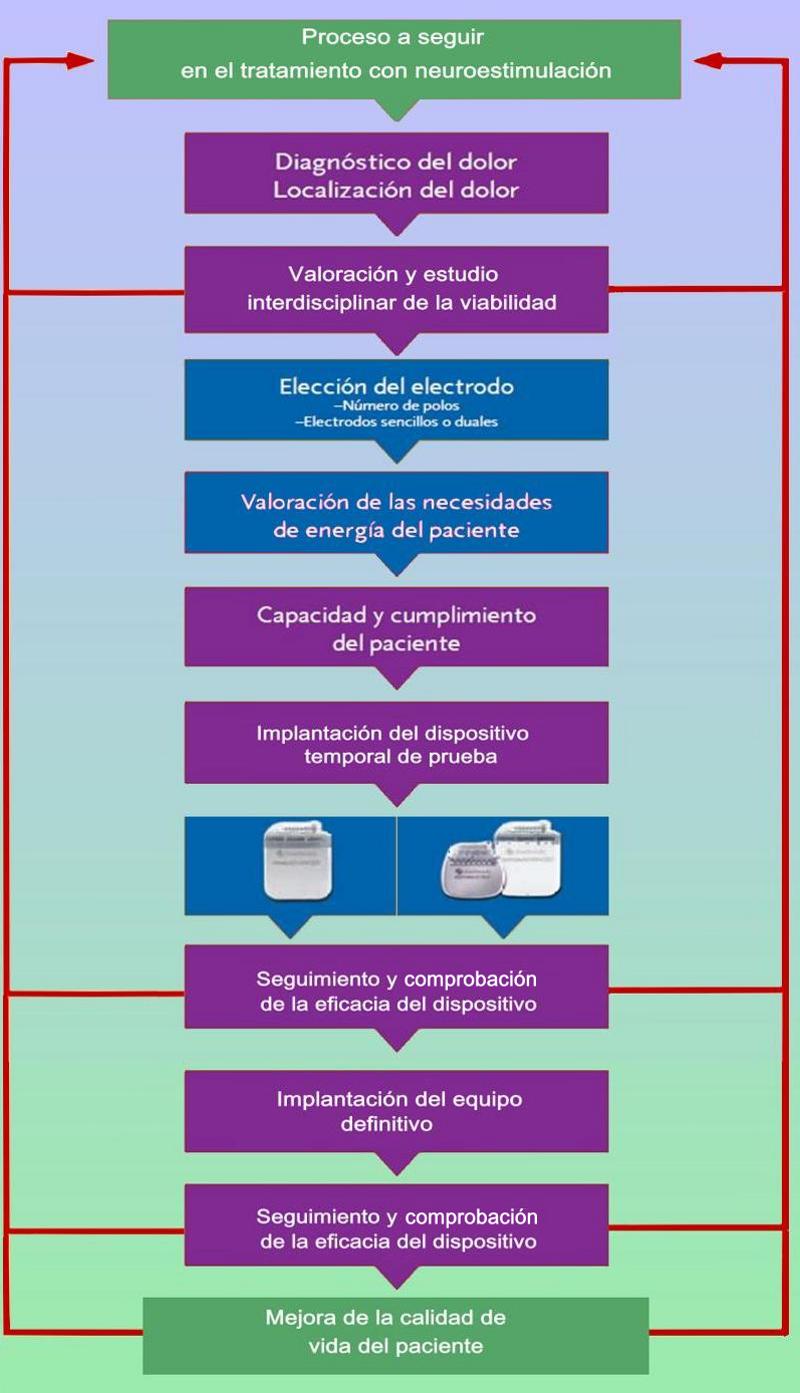
Pues bien, una vez el paciente es seleccionado tras seguir un riguroso protocolo y la comprensión por parte del equipo médico de estar frente a la solución adecuada se procede a la implantación, cuyo tratamiento consiste en la colocación de electrodos en el espacio epidural, ya sea a través de un abordaje percutáneo (utilizando los llamados cables percutáneos) o a través de un abordaje quirúrgico por medio de una hemilaminectomía (utilizando cables quirúrgicos o dispositivos potenciales de placa). Siendo los cables percutáneos de 8 contactos independientes, aunque las placas más modernas conducen 16 contactos. Los cables percutáneos generalmente se insertan directamente a través de una cánula Tuohy modificada o de un híbrido de plomo, a través de un introductor de plástico más amplio, utilizando comúnmente la técnica de Seldinger. Una vez colocado en el espacio epidural, el cable recubierto se avanza bajo guía fluoroscópica, usando un estilete extraíble. Una vez alcanzado el objetivo, el conductor se implanta cerca del nivel segmentario espinal que corresponde a la zona del dolor en la columna dorsal que se pretende bloquear. El punto de colocación adecuado es muy importante y se basa en gran medida en los datos obtenidos a distintos niveles y la experiencia del equipo que realiza la intervención, intentando localizar el mejor sitio a través de los variados métodos y procedimientos disponibles según el caso concreto. Una vez colocado el dispositivo, se activa a través de un control externo y se regula progresivamente con la apropiada colaboración y comunicación con el paciente con el objeto de obtener máximo alivio del dolor. Como ya he comentado muchas veces, es importante la selección cuidadosa de los pacientes para aumentar las probabilidades de un buen resultado que exige un buen trabajo interdisciplinario, donde el paciente debe ser sometido a una evaluación psicológica profesional, además de la realización de ayudas diagnosticas como la Resonancia Magnética del canal espinal.
Un factor determinante para el éxito de este método, es el implate previo o mejor dicho la “estimulación de prueba”, donde la evaluación de los resultados en un corto período inicial, podrá dar pistas concluyentes sobre el resultado de este tratamiento a largo plazo.
En la práctica diaria tras la implantación habrán una gran cantidad de herramientas de seguimiento que van desde reducciones en las puntuaciones de las escalas de dolor, mejoría en la funcionalidad del paciente, reducción de las dosis de analgésicos o la combinación de todas estas en lo que podríamos resumir como la mejora de la calidad de vida. Pero hay que ser claros, es importante tener en cuenta que incluso una prueba de implantación exitosa, no es garantía siempre de un éxito completo a largo plazo, aunque los datos indican un elevado porcentaje de éxito, si la prueba inicial resulta positiva, no garantiza al 100% un éxito rotundo ni continuado en todo los pacientes, pueden ocurrir “fases” donde el efecto analgésico decaiga o ciertas complicaciones de diversa índole desde fallos en los dispositivos a complicaciones variadas incluidas infecciones o hasta accidentes relacionados con la propia naturaleza del dispositivo. Ventajas, progresos… problemas y criterios de exclusión Desde que en el año 1967 Shealy describiera los primeros casos de electrodos implantados a lo largo de los cordones posteriores de la médula, basándose en que a dicho nivel se encuentra la mayor concentración de fibras de conducción rápida, pese al leve parón que supuso durante cierto tiempo la necesidad del avance tecnológico, su desarrollo ha sido progresivo desde entonces como ya he contado. La laminectomía inicial para implantarlo, dio paso a las técnicas percutáneas y a la implantación definitiva de los estimuladores en la década de los setenta y aunque sus bases de funcionamiento se basaron inicialmente en los criterios de Melzack y Wall y su teoría de la compuerta, con el progreso en la investigación ya hemos visto como se han involucrado una gran cantidad de neurotransmisores y procesos cruzados. Se han encontrado nuevos problemas y complicaciones a la vez que se han ido resolviendo tanto los antiguos como los nuevos, con propuestas tecnológicas y procedimientos quirúrgicos cada vez más avanzados.
Las mejoras del hardware fueron muy importantes con el paso de los sistemas unipolares a los multipolares, así como las mejoras en el control de los dispositivos, pues la facilidad y precisión para modificar la corriente y otros parámetros de estimulación suministrados por los electrodos puede ayudar mucho a aliviar el dolor del paciente. Actualmente los pacientes gracias a los controles remotos pueden controlar la intensidad de la señal emitida por el neuroestimulador y sus características con los programas pre-establecidos y previamente “calibrados” por su especialista tras las pruebas iniciales, facilitando la configuración óptima para mejorar su calidad de vida según por ejemplo las diferentes posturas que este pueda adoptar (de pie, sentado o tumbado) o las actividades a realizar.
Actualmente, por ejemplo, se realiza la hemilaminectomía bajo anestesia general en la colocación de un neuroestimulador para controlar el Dolor de Espalda por Cirugía Fallida (FBSS) asegurando que las parestesias abarquen toda la zona dolorosa y resulta imprescindible comprobar la eficacia de estimulación durante un periodo de prueba que oscila entre 1 y 3 semanas. Durante este tiempo de comprobación el especialista interrogará al paciente sobre las parestesias, el alivio del dolor y sobre la calidad de vida su humor, calidad del sueño, relación social, actividad física, etc.). Si la mejora substancial de todos estos parámetros es evidente, harán al paciente candidato al implante definitivo del neuroestimulador. Pero una vez implantado el sistema, debe procurarse la estimulación óptima con el nivel adecuado de programación que permita a través de la colaboración del paciente un uso óptimo. Durante los últimos años se ha intentado hacer mucho hincapié en la “comodidad” de estos dispositivos, lo cual también ha evolucionado gracias al avance tecnológico en diversas ramas ya citado, por ejemplo ya se cuenta desde el año 2005, con generadores de pulsos recargables. Las piezas implantables de estos dispositivos tienen una media de unos 5 cm de longitud y menos de 1,5 cm de grosor aunque estas cifras ya han alcanzado valores notablemente más bajos como los de los últimos modelos más recientes mencionados en anteriores reportajes. Los pulsos eléctricos que convierten las señales de dolor en una leve sensación de hormigueo llamada “parestesia" y que la mayoría de los pacientes describen como un “hormigueo”, se controlan con estos sencillos controles remotos, diseñados para interactuar con comodidad y sencillez con el paciente, a su vez la recarga de la batería se realiza con unos cargadores que se colocan sobre la piel, en el lugar en el que está implantado el neuroestimulador y en función de la configuración de estimulación del paciente, una carga de la batería puede durar de uno o dos días hasta un mes, dependiendo de la potencia empleada. Las actuales baterías recargables pueden durar hasta 25 años sin necesidad de sustituirse, dependiendo del uso y los parámetros de estimulación, una gran ventaja frente a los antiguos dispositivos no recargables y que normalmente tenían que sustituirse mediante una nueva intervención quirúrgica. Los neuroestimuladores no son teléfonos móviles y eso se ve muy claro en la tecnología de sus baterías, donde se procura emplear la más avanzada tecnología y calidad para evitar problemas, si por cualquier motivo y sin importar el número de veces que esto ocurra, un paciente olvida recargar la batería y esta se descarga por completo, la batería podrá seguir recargándose sin sufrir daños, evitando daños en la batería para que esta no tenga que sustituirse mediante otra intervención quirúrgica.
Medtronic
Pero no todo es color de rosa, cualquier cirugía conlleva sus problemas, al igual que con cualquier otro dispositivo o electrodo implantado, el cuerpo creará de forma natural tejido cicatricial alrededor del mismo como parte del proceso de curación y este tejido cicatricial por ejemplo, puede reducir la cantidad de corriente eléctrica que es posible suministrar a la zona correcta de la médula espinal. Esta situación se conoce como aumento de la resistencia. Por suerte los avances en electrónica permiten ajustar automáticamente y cada vez con mayor precisión la cantidad de corriente suministrada a cada contacto de electrodo individual para superar cualquier cambio en la resistencia que pudiera ocurrir, esto es muy importante pues se debe garantizar que la corriente se suministre a la zona y en la intensidad correcta, para que el paciente pueda continuar obteniendo los beneficios del tratamiento independientemente de los cambios de impedancia del circuito. Riesgos: Por un lado es un dispositivo electrónico y aunque se intenta que cada vez este más “aislados” en todos los sentidos, no nos engañemos hay riesgos de interferencias con otros dispositivos, tales como marcapasos y desfibriladores. Además una vez se implanta, ya no podremos someternos a una resonancia magnética con muchos modelos. Por otro lado, en el momento de la cirugía nos enfrentamos a los típicos riegos de cualquier intervención: Reacciones alérgicas a los medicamentos empleados, sangrados, problemas respiratorios e infecciones. Pero además, las características de la propia intervención acarrean sus propios riesgos: Filtración de líquido cefalorraquídeo (LCR). Daño a los nervios que salen de la columna vertebral, causando parálisis, debilidad o dolor que puede no desaparecer o incrementarse. Infección en los lugares donde se implanta el dispositivo con la pila o los electrodos y que puede hacer necesario retirar el neuroestimulador. Movimientos, desplazamientos o daños en el generador de la señal o los cables que requieran cirugías adicionales Dolores inesperados después de la cirugía. Problemas en la manera de funcionar del neuroestimulador, como el envío de una señal demasiado fuerte, débil o mal “calibrada” (de ahí la importancia vital de una buena comunicación con el profesional encargado de los ajustes de la señal) o problemas de “hardware” que provoquen detenciones y reinicios del sistema con la consiguiente pérdida de la “programación ajustada”. Una vez más, la experiencia y cualificación del equipo que realice la intervención puede ser determinante para evitar complicaciones, pues requiere un preciso conocimiento de la anatomía implicada y el procedimiento, así como de las características inherentes al propio dispositivo. A veces los pacientes consideran que una vez la cirugía ha concluido y siendo un “éxito” su dolor debería desaparecer por “arte de magia” pero los neuroestimuladores NO solucionan el problema de origen, su misión es paliar el dolor crónico y esto puede suceder en diferente medida. El nivel de dolor normalmente se verá reducido en un porcentaje muy alto, en otros no tanto, pero además este porcentaje puede variar con el paso del tiempo, llevando a “días mejores” y “días peores”. Desde antes de la operación el paciente debe ser convenientemente informado, a ser posible conocer las experiencias de otros pacientes que les informen de una manera amable pero rigurosa en un lenguaje “natural,” se ha demostrado que puede ser beneficioso bajo la supervisión del equipo de especialistas que aborden cada caso concreto con la ayuda de otros antiguos pacientes que apoyen la preparación de los nuevos con el relato de sus experiencias claramente explicado. A veces se puede despertar de la cirugía confusos y con un grado de dolor, proveniente por ejemplo de las propias características de la intervención que provoquen en el paciente un estado de sorpresa o decepción que incremente las probabilidades de fracaso de la intervención a causa de la poca colaboración posterior del paciente ante las expectativas iniciales y el desconocimiento preciso de la fase post-operatoria.
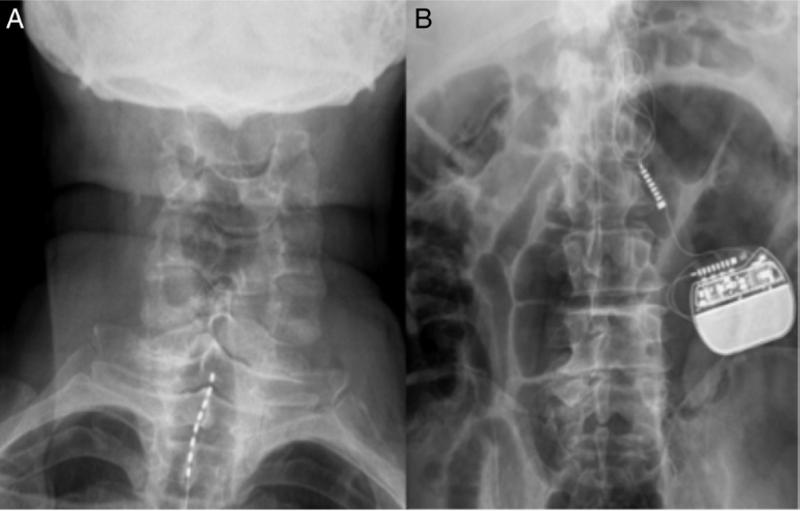
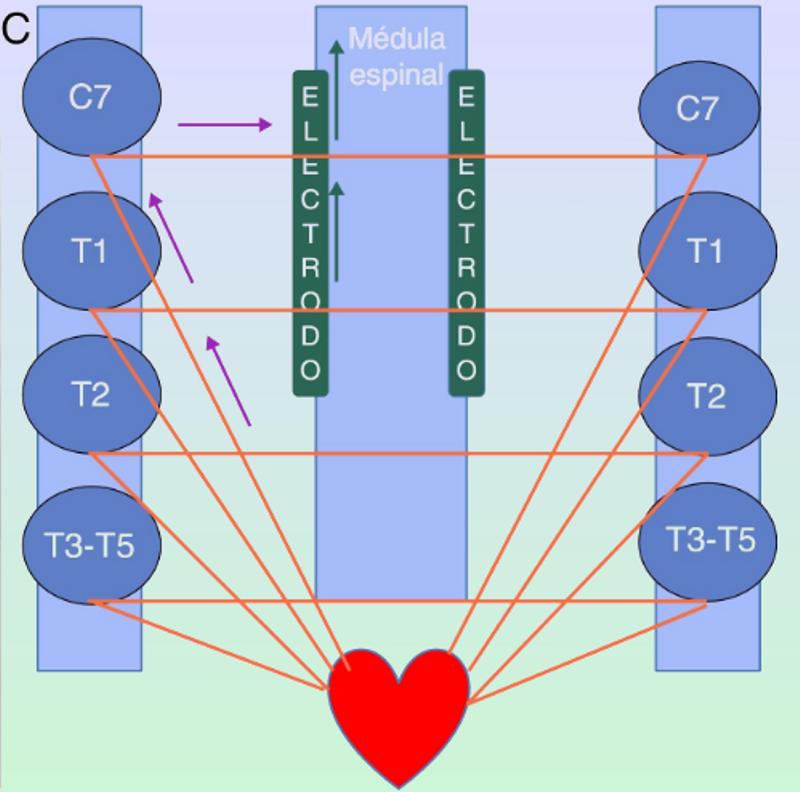
En la imagen ejemplo de radiografías postoperatorias en el caso de una implantación de NE en el espacio epidural Neuroestimulador espinal para el tratamiento de la angina cardiaca refractaria A) Radiografía AP de columna de unión cervicotorácica que muestra electrodo percutáneo implantado en el espacio epidural posterior en línea media a nivel de C7-T2 niveles óseos. B) Radiografía AP de abdomen simple que muestra el generador de pulsos implantado en el flanco izquierdo. C) Inervación cardíaca y efecto de la neuromodulación en los cordones posteriores de la médula espinal. Las flechas moradas indican aferencias simpáticas. Las flechas verdes indican modulación de las aferencias en los cordones posteriores de la médula espinal. Elsevier / Revista Colombiana de Cardiología
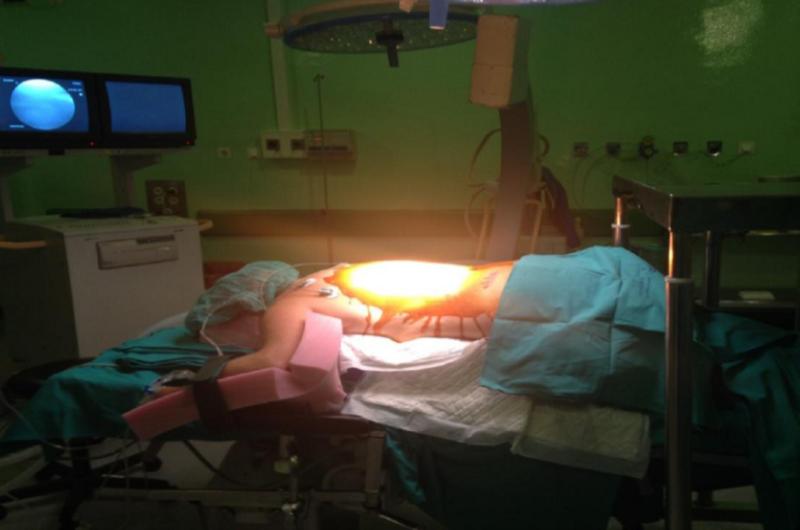
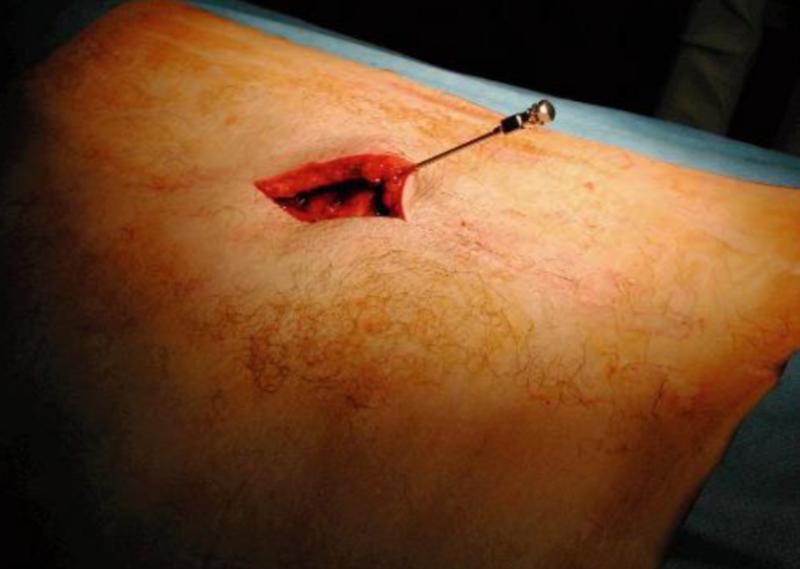
Y llegó el día… Una vez más recordar que dividiremos el implante en dos fases y por tanto realmente hablamos de dos intervenciones: 1era: colocación del o los electrodos epidurales y conexión a generador externo para la fase de prueba de terapia 2da: implante del generador definitivo (si ha sido satisfactoria la fase I en cuanto a alivio de la sintomatología dolorosa). Como en cualquier otra intervención habrá que informa al médico y al personal de enfermería qué fármacos está tomando, incluso los medicamentos u otras “hierbas” que hayamos comprado sin “receta”, durante los días previos a la cirugía, deberemos preparar la casa para nuestro regreso, sobre todo si no contamos con “mucha ayuda” este no es un detalle pequeño. Si somos fumadores o hemos estado bebiendo mucho alcohol (mal empezamos), lo aconsejable debe ser dejar de fumar y beber, la recuperación será más lenta y posiblemente no tan buena si se seguimos fumando o ingiriendo cualquier cantidad de alcohol, aunque seamos sinceros, la ausencia de la nicotina que alimenta nuestra adicción u otras puede empeorar el problema, así que seamos honestos y pidamos consejo al médico para dejar de fumar o sobre-llevar la situación adictiva de una manera realista, es determinante dejar de lado la ansiedad y muchos efectos secundarios de las adicciones a la hora de emprender la evaluación y ajuste de nuestro nuevo dispositivo implantado en las siguientes semanas y si hemos llegado a esta solución es más que probable que hayamos acabado con alguna “adicción del tipo que sea” y debemos hacerle frente de manera honesta guiados por un equipo de profesionales que garanticen el éxito de la intervención. Varias semanas antes de la cirugía, nuestros especialistas puede solicitar que dejemos de tomar ciertos fármacos que dificulten la coagulación de la sangre, como el ácido acetilsalicílico, ibuprofeno, etc.. u otros fármacos. Si tenemos diabetes, cardiopatía u otros problemas de salud, el cirujano deberá realizar una consulta interdisciplinar para garantizar la viabilidad de nuestra intervención así que es importante un conocimiento pleno de nuestro historial y evitar riesgos innecesarios. Una vez más la comunicación es determinante como en cualquier intervención existen riesgos y tenemos que ser plenamente conscientes. ¡Atención! Si tenéis verdadera curiosidad por saber cómo se realiza una intervención para implantar un EME, os dejo la descripción en profundidad de las dos fases, descritas por la Dra. Eva María Ruíz Pavón en la colocación de un neuroestimulador para control del dolor de espalda por cirugía fallida (FBSS) aunque si sois un poco aprensivos, os aconsejo no pasar de este punto, quizás las imágenes puedan herir un poco vuestra sensibilidad. Pero resulta un ejemplo muy gráfico de como se realiza la intervención.
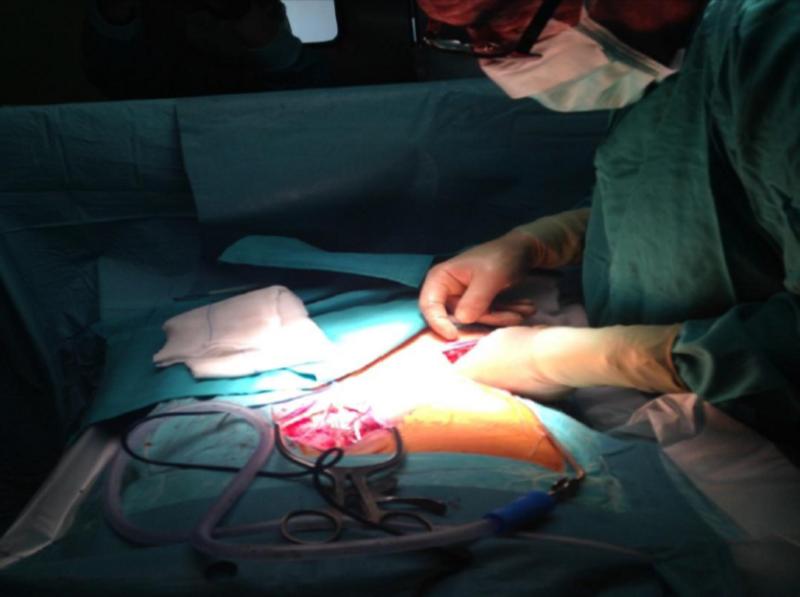
Imágenes de la primera fase de una intervención para la colocación de un neuroestimulador para control del dolor de espalda por cirugía fallida. El posicionamiento será realizado por celadores, enfermeras, anestesiólogo y cirujanos; siempre protegiendo la integridad física del paciente. Tras la colocación, el cirujano procede a la identificación de la zona de implante con Rx y marca con aguja o rotulador dermográfico.
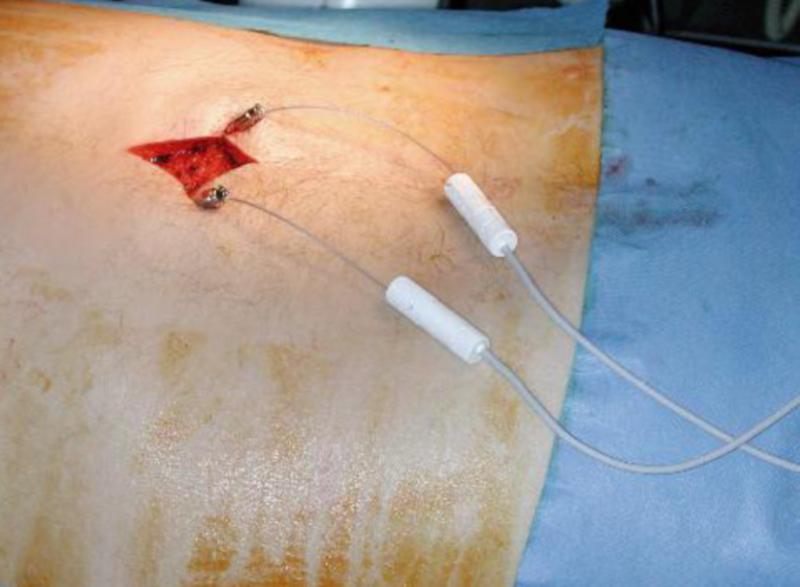
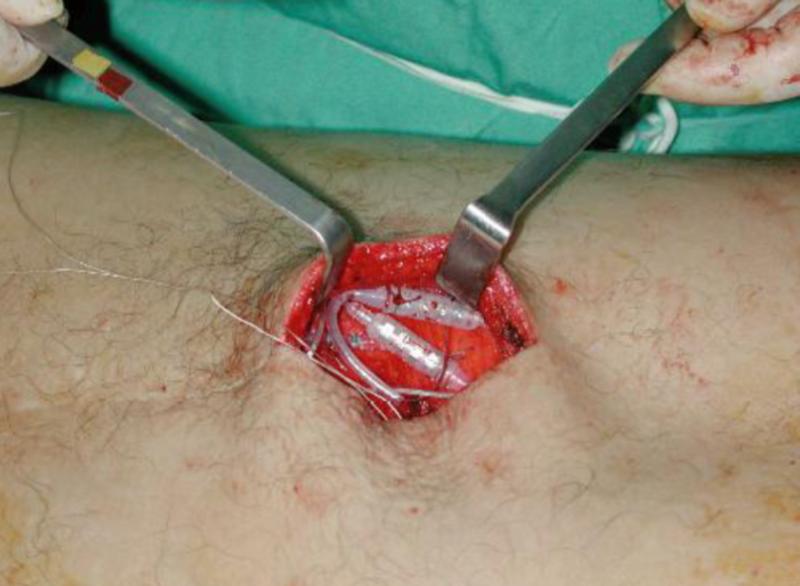
La Técnica Quirúrgica es una Laminectomía: (apertura de la lámina vertebral para permitir el paso del electrodo) que debe hacerse un cuerpo vertebral y medio por debajo de dónde debe quedar colocado el electrodo. Técnicas que se utilizan para saber si estamos en espacio epidural: Jeringa de Baja Presión: Hay resistencia a meter aire, hasta que estamos en espacio epidural, que la jeringa se desliza rápidamente al perder esa presión. Gota Pendiente: Con jeringuilla de insulina con suero, se pone una gotita en la entrada de la aguja de Tuohy, al entrar en espacio epidural la gota de suero debe ser aspirada hacia dentro y desaparecer (se queda en ligamento Amarillo). Si después de haber hechos estas técnicas todavía no estamos seguros de estar en espacio epidural, podemos introducir la guía del electrodo, siempre con rayos y ver cómo va subiendo. 1. Cuando es seguro de que estamos en espacio epidural, introduciremos el electrodo hasta llegar a la altura que queremos dejar la punta, también es necesario comprobar si esta en Anterior con Rayos Lateral. 2. Una vez tengamos el electrodo en el sitio que queremos, conectamos los Cables OR al electrodo y al ETS y medimos impedancias. Solo hay que retirar el rotor, no el estilete ni la aguja, porque si hay que mover el electrodo es necesario el Estilete. 3. Los valores normales de impedancias deben de estar entre 200 – 4500 Ohm Ya cubierta la zona de dolor con estimulación, quitamos el estilete y la aguja y procederemos a anclar el electrodo con el sistema Click Anchor, para el cual hay que tener en cuenta: Se debe de colocar donde se atornilla hacia afuera y ponerlo lo más centrado posible. Suturar primero las alitas. Hacer Rx para comprobar que no ha habido desplazamiento del electrodo. Atornillar hasta que suene. A continuación: Poner el tunelizador en perpendicular sobre un paño para no romper el campo estéril. La T introducirla en el tunelizador hasta que encaje perfectamente Enroscar. El tunelizador se puede doblar un poco y utilizar en ambas direcciones. Tener cuidado porque la punta desgarra Con un bisturí frio tienen que hacer una pequeña incisión que será por donde salgan las extensiones. Se tuneliza hasta la salida y se introducen las extensiones por la vaina del tunelizador hasta que salgan por el orificio. Se conectan las extensiones a los electrodos y antes de atornillar se miden impedancias, que están bien, se atornilla, si no es porque o bien estén manchadas las conexiones o bien se han introducido mal. Los electrodos deben quedar “enterrados” en la incisión, colocados de forma holgada mediante un bucle para evitar tensión o desplazamientos pasando a cerrar por planos con Sutura reabsorbible 2-0 y grapas en la piel. Hay que conectar nuevamente los extremos de la extensión percutánea al cable de prueba, con una fijación segura para evitar desplazamientos mediante vendaje bioclusivo. Por último se conectará el analizador de parestesias sobre el cable de prueba y se pondrá en funcionamiento el sistema con la comprobación de la cobertura adecuada de las parestesias sobre la zona a tratar del paciente. Este último punto debe realizarse cuando el paciente se encuentre en posición de decúbito supino en su cama o en la habitación explicándole con detalle los cuidados mínimos que debe tener con el sistema, su temporalidad y la fase de prueba.
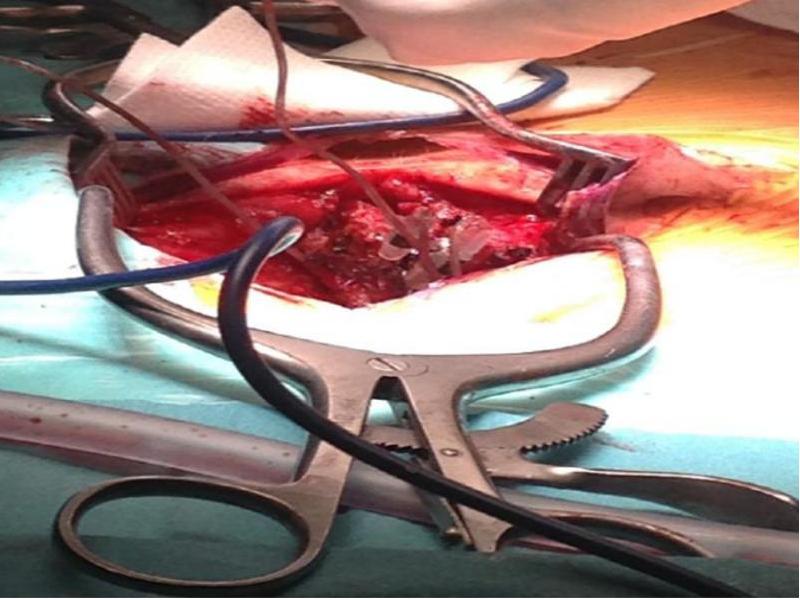
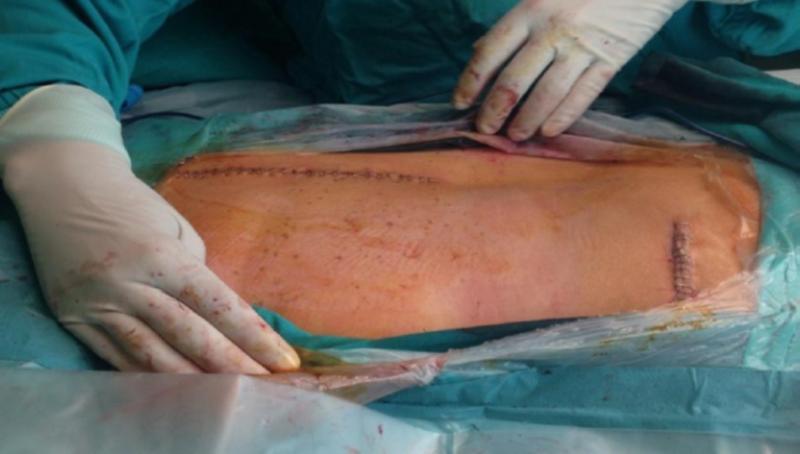
Segunda fase: implantación del generador definitivo
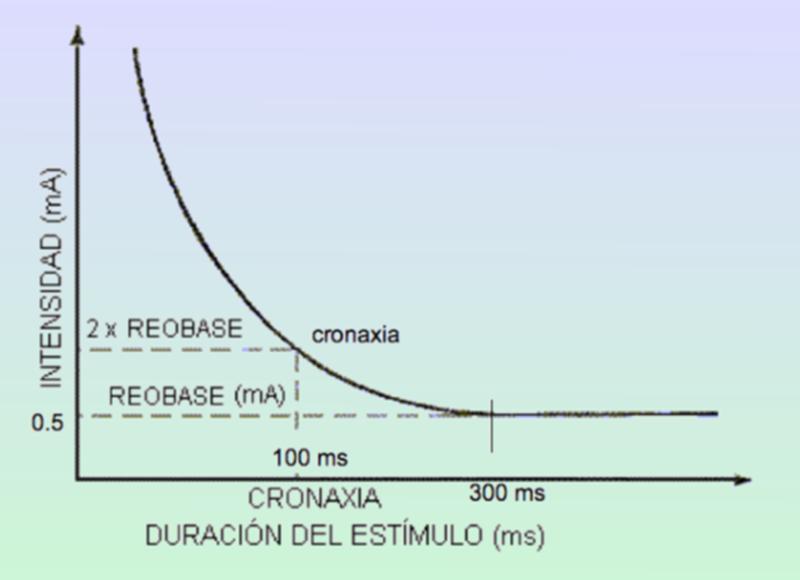
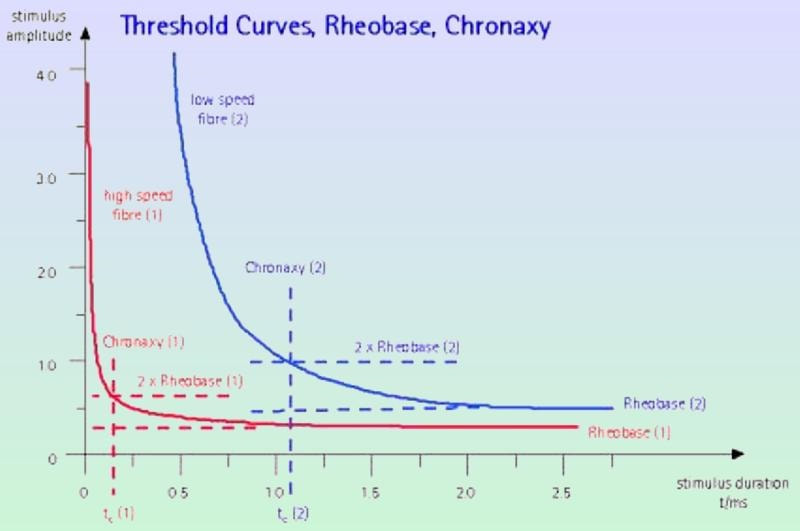
Exposición de Los Electrodos y Conectores: Primero se abre la incisión donde están las conexiones para desconectar las mismas. Para ello necesitaremos abrir el KIT extensiones para poder utilizar el destornillador, se procede a la apertura de la herida central, se buscan las conexiones del electrodo y la extensión para desatornillarlo y ya libres se procede a la retirada de las extensiones por el lateral para evitar todo riesgo de infección. Se procede a hacer la incisión del IPG, en el lado contrario de donde han salido las extensiones para evitar infección. Se abrirá el Kit del IPG y tenemos que tener en cuenta lo siguiente: Utilización de la plantilla para comprobar que el bolsillo tiene las medidas adecuadas. Montaje del tunelizador: Colocación de los tapones en el IPG para comprobar que los canales están abiertos y para evitar que se introduzca sangre en el caso de introducir el IPG en la incisión Colocación De La Extensión: La extensión del electrodo desde su localización lumbar hasta el generador se realiza también con la ayuda de un tunelizador y a veces se pasan directamente los electrodos. Cierre por planos de sutura, comprobando que el electrodo y la conexión queden mediante un bucle sin doblarse ni torcerse dentro de la inserción lumbar, separados de la línea media y convenientemente “enterrados” para que no moleste al paciente cuando apoye sobre esa zona, Si las extensiones son nuevas hay que hacer pruebas de impedancia con el OR, si todo está bien, se puede proceder a los últimos pasos: insertar el extremo del electrodo sobre el conector de la extensión y alinear las bandas metálicas bajo los tornillos de fijación, apretar estos tornillos(no hacerlo en exceso), tirar suavemente para comprobar que está sujeta la conexión, suturar alrededor de los extremos de la funda. Sujeción de la Extensión al Generador: Las patillas de conexión de la extensión se colocan en el conector del neuroestimulador, limpiando previamente de cualquier resto de fluido corporal, apretando los tornillos de fijación. Se introduce entonces el generador en el bolsillo subcutáneo, enrollando bajo el perímetro del mismo el hilo de prolongación sobrante y comprobando que la parte escrita del generador mire hacia la piel. Cierre de planos por sutura, cura y colocar apósitos estériles. Ruiz Pavón, Eva Mª. Enfermería en la colocación de un neuroestimulador para control del dolor de espalda por cirugía fallida. Biblioteca Lascasas, 2015; 11(3). El procedimiento completo lo podéis encontrar en http://www.index-f.com/lascasas/documentos/lc0849.php Fundamentos técnicos básicos en neuroestimulación Para finalizar y ahora que ya hemos intentado diferenciar las aplicaciones y conocemos un poco más su uso existen unos pocos términos y fundamentos físicos que debemos conocer para empezar a profundizar, de lo contrario es imposible llegar a comprender el funcionamiento de estos dispositivos más allá de que producen “corriente” en nuestras conexiones neuronales. Pues bien, La electroneuroestimulación se basa en la generación de un potencial de acción en una fibra nerviosa tras la despolarización de su membrana mediante una corriente eléctrica. Para ello es importante conocer tos términos esenciales asociados a esta corriente: Reobase: mínima intensidad de corriente continua que, aplicada durante un tiempo suficientemente largo es capaz de provocar la despolarización celular. Estas corrientes mínimas o reobases son distintas para las distintas fibras nerviosas aisladas, de igual manera también serán diferentes dentro de un mismo nervio ya que la distancia a la que está situado el estímulo afecta en forma distinta a los axones que se encuentran más cerca o más lejos del mismo. Cronaxia: tiempo mínimo de aplicación de una corriente continua para producir despolarización celular con una intensidad doble de la reobase. Como ya he emncionado la corriente necesaria para estimular un nervio dependerá del ancho del pulso o sea, de la duración del estímulo. Así la cronaxia puede ser usada como una medida del umbral de estimulación para cada nervio en particular, siendo útil cuando se comparan diferentes nervios o tipos de fibras nerviosas. Las fibras más gruesas son más fácilmente estimuladas que las más pequeñas. Una fibra motora puede ser estimulada con una duración de pulso de 100 msec sin producir dolor, ya que las fibras sensitivas no son estimuladas con esta duración de pulso y sí lo son con duraciones mayores. En cambio si estimulamos con una intensidad de 0,5 mA, pero con una duración de estímulo de 0.3 msec no solo obtendremos respuesta motora sino también probablemente parestesias dolorosas. Este potencial de acción responde al principio del todo o nada (para quien entienda un poco de física y fotones, en cierta manera es bastante similar, salvando las diferencias, respecto al concepto cuántico y la energía necesaria para “mover” un fotón, pero hablamos de impulsos eléctricos en neuronas), es decir, existe una intensidad mínima de corriente para la propagación del impulso y por mucho que aumentemos esta cantidad de corriente no vamos a aumentar la respuesta. El potencial donde permanece en reposo una célula nerviosa es aproximadamente –80 mV, estando el interior celular cargado negativamente respecto al exterior (Imaginaros que la célula nerviosa fuera como una pequeña pila de botón y que su interior fuese como un polo negativo). Al aplicar una corriente eléctrica de suficiente intensidad para producir un decremento en el potencial de membrana de –55 mV se generará pues un potencial de acción, o lo que es lo mismo, si estuviéramos hablando de pilas, consistiría en aplicar diferenciales de potencial que venzan la resistencia y provoquen una corriente eléctrica, algo así como acercar a un electrodo negativo recubierto de una finísima capa aislante un electrodo positivo y elevar gradualmente la tensión hasta un punto que la diferencia de potencial vencerá la resistencia provocando el paso de la corriente, salvando las diferencias sirve para hacerse una idea sencilla.
La reobase de un nervio, es la corriente minima que se debe aplicar al nervio para despolarizarlo con un pulso largo (en el ejemplo para 300 mseg). Se corresponde habitualmente con una intensidad de corriente de 0.5 mA. En el ejemplo, si se aumenta la duración del impulso a 500 o a 1000 ms, y se disminuye la intensidad de la corriente, no se producirán respuestas motoras con intensidades menores que las obtenidas antes a 0.5 mA. Dr Carlos A. Bollini, Dr Fernando J. Cacheiro, Dr William F. Urmey
Los parámetros de la corriente eléctrica que necesitamos conocer son: intensidad, duración, voltaje o diferencia de potencial, frecuencia y forma de onda (los menos aficionados a la electricidad os aconsejo deis una ojeada a los artículos sobre esto aquí, parauna idea rápida) Por sus características electrofisiológicas, en la estimulación de las fibras nerviosas, la corriente debe ser continua y con forma de onda cuadrangular, el amperaje (Intensidad) necesario para conseguir el potencial de acción es muy pequeño, del rango de los 0,5 mA, para intensidades inferiores a 0,1 mA el tiempo de estímulo debe ser muy alto y por encima de 1,5 mA el estímulo puede volverse doloroso o causar lesiones nerviosas. Es importante que tengamos claro que lo que determina la despolarización es la relación entre la intensidad y la duración del estímulo y no el voltaje Anchura de pulso o duración del estímulo: duración adecuada y relacionada con la cronaxia de las fibras motoras en los nervios periféricos. Voltaje: es suficiente con que generemos un diferencial de potencial de 1 – 10 V en cualquier modalidad La Frecuencia, generalmente está en el rango de 1 – 4 Hz en neurolocalización y aumentarla no sirve para nada a causa del fenómeno de retardo sináptico, que consiste en un retraso en la conducción entre sinapsis de al menos 0,5 ms, ya que este es el tiempo necesario para que sea liberado el mediador sináptico y para que actúe en la membrana postsináptica. Por ello, la utilidad de variar la frecuencia por ejemplo en ayuda diagnóstica o neurolocalización es diferenciar la respuesta motora de la estimulación de los movimientos voluntarios en pacientes poco colaboradores o con trastornos del movimiento como el temblor esencial.
Reobase y Cronaxia de una fibra rápida y una lenta: En la imagen se pueden ver dos fibras nerviosas distintas. En rojo una fibra rápida y en azul una fibra más lenta, el área que queda situada a la izquierda de la curva no es estimulable a esa combinación de intensidad y duración de pulso, en la figura por ejemplo con un estímulo de 1.0 msec y una intensidad de 0.2 mA. Sin necesidad que sean dos fibras distintas esto mismo sucede con una aguja localizada a distancia del nervio o en contacto con el punto de mejor estimulación. Dr Carlos A. Bollini, Dr Fernando J. Cacheiro, Dr William F. Urmey
Ahora bien en EME la cuestión varia, generan impulsos eléctricos de frecuencias en el rango 40 a 60 Herzios, la sensación que producen los neuroestimuladores varía de persona a persona pero es normal sentir un hormigueo suave en la zona dolorida, en los últimos años se han estudiado otras alternativas con el uso de la neuroestimulación en alta frecuencia. La HF10 o estimulación medular de alta frecuencia supone la aplicación de impulsos de corta duración (30 microsegundos) y alta frecuencia (10 kHz) y baja amplitud (de 1 a 5 mA) en el espacio epidural espinal, observándose desde finales del año 2013, cuando comienzan a emplearse estos dispositivos de alta frecuencia mejoras en los pacientes a la hora de aliviar el dolor lumbar el dolor radicular o de miembros inferiores. Corriente continua:. Lógicamente, para obtener siempre el estímulo de una forma ¨continua” en la punta de la aguja y no “alternar” el estímulo entre la aguja y el electrodo precisamos una corriente continua. (Tan solo encontraremos habitualmente el uso de corriente alterna en TENS) Onda cuadrangular: Quienes ya sepáis las diferencias entre electrónica analógica y digital no tendréis ningún problema para entender esto, ya que consiste básicamente en emitir pulsos de corriente con un ascenso rapidísimo que se mantiene a una tensión e intensidad constante para caer bruscamente, como en la comunicación binaria, ya que las corrientes que ascienden lentamente pueden provocar la acomodación del nervio e impedir su despolarización, por tanto el ascenso brusco en la intensidad de la corriente cuadrangular es el idóneo. Bueno, creo que por hoy ya es suficiente. En próximas semanas publicaremos un anexo extenso únicamente con bibliografía, documentación y enlaces para que quienes os hayáis interesado podáis profundizar a cualquier nivel tanto del dolor, el SDRC u otras enfermedades, donde el dolor se impone, así como en estos dispositivos, va a ser un trabajo un tanto “duro” precisamente para que podáis ir directos al grano. Sergio González, René Otegui, Ismael Ramos, Maite Padilla, Sebastián, Lilian, Marta (Pandora), Elisa López, Nerea (Mitoguerrera), Sonia, Andrea y a todos aquellos que también siguen por la senda más dura. Siempre existe un final del camino, sólo hay que encontrarlo y sé que todos vosotros lo hallaréis sin duda. ¡Mucho Ánimo! Te puede interesar:
Autor: Inflexion Point Doctor
Puedes pinchar aquí para acceder a la primera parte: Neuroestimulación y dolor crónico, principios esenciales en la medicina moderna Puedes pinchar aquí para acceder a la segunda parte: Neuroestimulación y dolor crónico. Cuando el cerebro pierde el control de las alarmas - 2da Parte Temas relacionados: Divulgación científica, Biomedicina, Medicina, Inflexion Point Doctor, Enfermedades Raras Reconocimientos y más información sobre la obra gráfica ADVERTENCIA: En este foro, no se admitirán por ninguna razón el lenguaje soez y las descalificaciones de ningún tipo. Se valorará ante todo la buena educación y el rigor sobre el tema a tratar, así que nos enorgullece reconocer que rechazaremos cualquier comentario fuera de lugar.
26 Comentarios
Sonia
23/5/2018 13:15:45
Buenos días equipo :
Responder
Noelia
23/5/2018 13:26:38
Ánimo,os queremos,no entiendo muchas cosas. Sólo espero que quien tiene soluciones investigue
Responder
Germán Cobos
23/5/2018 14:34:48
Felicidades por este enorme resumen histórico, confieso haber entrado por eso, desconocia las variantes de la ne. creía que la neuroestimulación era otra cosa, más parecida a los aparatos caseros de body building. ¿Nadie se ha dado cuenta al leer el artículo que uno de los doctores de The Nick está inspirado en William Halsted? lo acabo de descubrir, así que gracias. Ya que viene a cuento, a los enganchados a las series, la aconsejo a "muerte". ¡Fuerza a todos los que padecen enfermedades con mucho dolor y pasan de vosotros!
Responder
La mula
23/5/2018 15:53:22
De verdad IPd J., no sé de donde sacas las ganas para hacer estos tratados del "entretenimiento instructivo" a veces a mí me gustaría largarme a una isla desierta a la espera del fin del mundo. Recupérate pronto, se te hecha de menos por tromalandia. Gracias por enseñarnos a pelear como sólo tu sabes. Una buena y cariñosa coz, de tu alumno más lelo. F.
Responder
22/9/2018 13:39:54
Ostras ya caigo!!! Cuantos años! Bueno de mula nada, por mucho que te guste ir de garrulín sobrado ahora, yo es que alucino....! Por lo que veo te convertiste en un caballo ganador! Ahora en septiembre con el P.A. intentaré pasarme por vuestra redacción a incordiaros un poco. Un abrazote F.
Responder
carmen
23/5/2018 17:07:28
yo lo llevo al principio bastante mejor pero no bien ahora nada lo ke no te dicen es ke sólo se puede retirar la pila lo demás es para toda la vida no se puede retirar
Responder
Inflexion Point
23/5/2018 19:18:37
Hola Carmen, en un principio lo que llamas "pila" es el "corazón" de un NE, (desconozco la generación y tamaño del tuyo) pero en volumen es la pieza principal. Pese al desarrollo de tejido cicatrizal, la posición de colocación debe fácilitar la estracción, los electrodos es un tema más delicado con el paso del tiempo, dado que contactan con los nervios y su manipulación lógicamente debe ser más delicada en caso de extracción, pero poco más, pero su tamaño por suerte no es significativo y las complicaciones descritas con el paso del tiempo escasas. Así que tranquila. Es cierto que con el tiempo algunos pacientes desarrollan falta de eficacia ante la parestesia, como ya he explicado, pero si tras el implante de prueba reduce el dolor de forma significativa, los contras son claramente asumibles frente a los fármacos, por suerte un electrodo actual está diseñado para resistir en el cuerpo humano "toda una vida" mucho más que las consecuencias para tus órganos del consumo continuo de opiáceos y analgésicos varios... Es una cuestión de pros y contras que te deben explicar bien (así que ante todo, gracias por el aviso... Deduzco que lo has llevado mucho tiempo y su efectividad se ha reducido, por otro lado también deduzco que es de batería no recargable por inducción... Bueno deducciones a ciegas que hago sin importancia) pero gracias por el apunte quizás debí profundizar un poco más en eso. Pero lo importante es que si obtuvieran una mejor solución para tu dolor, sencillamente el NE no se interpondría como ya he dicho y eso es lo esencial) Un saludo y ojalá que venzas a tu dolor.
Responder
Inflexion Point
23/5/2018 19:27:45
Extracción y estracción en la misma contestación... No tengo perdón lo sé pero desde el móvil pongo muchas tonterías ;-) Y por cierto ya que te respondo otra vez, te comento que falta un apéndice donde incluiré varios estudios médicos sobre complicaciones postoperatorias a largo plazo por si deseas indagar a tope sobre esto. Hay uno sobre la reacción en cadena a una picadura, alucinante! el ser humano es muy complejo
Responder
22/9/2018 13:45:39
Hola Carmen, de verdad, lo de la mala información médica por parte algunos profesionales tiene que terminar, como digo mil veces, es completamente irresponsable no informar adecuadamente sobre el uso, mantenimiento y consecuencias a largo plazo del implante, es una barbaridad y se sabe que el éxito depende del dialogo con el paciente y una buena formación previa para evaluar las opciones. Un abrazo Carmen
Responder
1/12/2018 20:03:04
Hola buenas tardes carmen a y me lo implantaron hace mes y medio y tengo bastantes problemas. Los estímulos me vienen al addomen Y constantemente tengo que bajar la intensidad Aparte de que yo he llevado uno 20 años y me implantaron titanio en la columna Me retiraron solo la pila pero tengo el resto en mi cuerpo Y ahora al implantar me el nuevo modelo donde tenía la pila anterior mente me duele y me baja asta la vejiga y todo mi addomen, me han dicho que si retiran lo anterior se puede coger una infección y pasar a la sangre Y estamos esperando a ver si se puede ajustar a mi cuerpo y poder llevarlo. Me han dicho que lleva su tiempo . Me han mejorado un poco el dolor de mis piernas Pero sigo con la morfina Gracias, por la explicación. Un saludo
Responder
Jesús
8/10/2019 18:24:39
Bien, en primer lugar, por causas ajenas a mi voluntad soy un enfermo de dolor crónico desde los 7 años (sshhh, no sé lo digas a nadie, ahora tengo 53) bromas aparte, he probado prácticamente todo lo referente a mitigar el dolor, fármacos (los últimos Fentanilo 1200, oxicodina 160 mg diarios, Lyrica 900 mg diarios, Cimbalta 150 mg diarios, y un largo etcétera, he tenido perfusiones de lidocaina, infiltraciones de botox, podría seguir pero no tiene sentido.
Responder
Elisa Martinez
23/5/2018 22:29:42
Gracias por la información, me plantearon un neuroestimulador hace 2 meses a raíz de una intervención por fractura en la tibia izquierda tras un accidente de coche hace casi un año, el dolor no cesa, dormir es imposible, es un ardor insoportable difícil de describir cuando ataca.
Responder
Inflexion Point
29/5/2018 23:43:26
Hola Elisa, llevo dándole vueltas varios días a ver cómo te contesto, ya que estoy terminando el apéndice sobre NE y he incluido varios documentos sobre complicaciones en este tipo de intervenciones. Como comprenderás yo no te puedo garantizar al 100% que una intervención la que sea se un éxito, la medicina no es magia, pero en condiciones normales, es una intervención considerada pese a todo poco invasiva o peligrosa, realizada por personal médico preparado (desde luego, dado el tipo de intervención, no es desde luego idónea para profesionales "principiantes") pero el riesgo de consecuencias muy graves es muy bajo. Si te lo han aconsejado, el tiempo es importante, cuando más tardes, la probabilidad de éxito se reduce y debes informarte bien para tener una actitud positiva y sin miedo, de lo contrario los resultados podrían no ser óptimos como he explicado. Por otro lado los riesgos comunes de infección y otras complicaciones de una cirugía no son más elevados ni mucho menos en este tipo de intervenciones. Si cuentas con profesionales de la medicina cualificados, no deberías tener miedo a las consecuencias más que a los riesgos de que el dolor que padeces se incremente a largo plazo. Ciertamente hay cirugías donde el riesgo no compensa, pero desde luego (y lo puedes consultar a tantos profesionales de la medicina como quieras) en este caso vale la pena los riesgos de una intervención, donde las probabilidades de algo tan grave como lo que comentas son realmente excepcionales, por ejemplo frente al riesgo estándar de una anestesia para realizar una intervención. No debemos enfrentarnos a las intervenciones con miedo más allá del razonable por el sentido común. Así que mucho ánimo!!!! ojalá consigas superar tu dolencia y no dudes en reflexionar con serenidad esta opción si te la han sugerido, pues el tiempo corre en tu contra para las probabilidades de éxito. Un fuerte abrazo Elisa :-)
Responder
Antes de nada, disculpa por haberme retrasado tanto en leerte, pero hay cosas que sencillamente olvido que existen, así es mi amiga la fibro.
Responder
Inflexion Point
5/6/2018 22:33:24
Hola Maite, antes que nada gracias por preocuparse, la verdad es que el percance con la bicicleta me ha atrasado un poquito la faena y contestarte, pero bueno, nada grave por suerte y ya estamos de vuelta, (a ver si lo repaso y antes del fin de semana pongo ya el apéndice de bibliografía y enlaces por fin)
Responder
Blanca
20/9/2018 02:50:04
Muy interesante el artículo pero por desgracia para mi madre de 78 años y para toda nuestra familia, un poco utópico!!!
Responder
22/9/2018 13:31:44
Hola Blanca!
Responder
Blanca Carreño Alonso
5/2/2019 00:51:46
Buenas noches,
Blanca
5/2/2019 01:05:01
Hola soy yo otra vez,
Responder
22/2/2019 21:11:02
Hola Blanca, disculpa el pequeño retraso en contestar, pero aquí estoy por fin. Ando metido entre otras cosas en un trabajo sobre dolor neuropático que me está resultando un poco eterno, pero en fin esto es así, complicado. Antes que nada gracias por explicarme la situación de manera tan pormenoriza, te lo agradezco mucho porque en algunos aspectos creo que es realmente atípica y ciertos comportamientos de los facultativos cuanto menos lo mismo por no decir claramente cuestionables, pero intentaré no prejuzgar.
Responder
22/2/2019 21:12:37
....sigo que se ha cortado...
Responder
José
12/9/2020 03:33:01
Hola,muy interesante material , de ante mano,te agradezco , entre mis dudas,esta si alguien le ah funciónado para la Neuralgia del trigemino? Llevo 20 largos años con esta patología ,la cual llevo 2 descompresión vascular , 1 craneotomia y 1 radiofrecuencia y los dolores y crisis cada vez más fuertes,estoy estudiando la posibilidad de neuroestimulador,pero necesito aclarar las dudas..
Responder
25/10/2020 17:21:37
Hola José, si lo que me preguntas concretamente es si el neuroestimulador funciona para esta patología tengo mis dudas, lo normal sería anticonvulsivos, espasmoliticos... hasta inyecciones de botox!, luego descompresión microvascular por cirugía, radiocirugía estereotáctica del cerebro o la destrucción de fibras nerviosas para reducir el dolor (rizotomía por glicerol, balón, radiofrecuencia, etc...)
Responder
Vanesa
30/11/2021 07:31:40
Buenos días,
Responder
7/12/2021 16:22:13
Hola Vanesa
Responder
Deja una respuesta. |